solo para uso en investigación
JNK-IN-8 JNK inhibidor
Cat. No.S4901
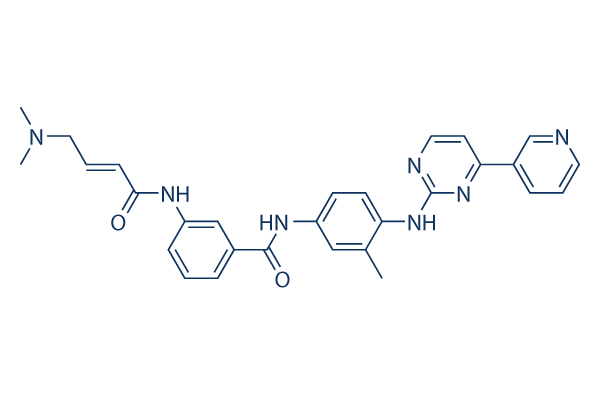
Estructura química
Peso molecular: 507.59
Control de calidad
| Dianas relacionadas | ERK p38 MAPK Raf MEK Ras KRas S6 Kinase MAP4K TAK1 Mixed Lineage Kinase |
|---|---|
| Otros JNK Inhibidores | CC-90001 SP600125 Anisomycin (Flagecidin) JNK Inhibitor IX Tanzisertib Hydrochloride (CC-930) JNK Inhibitor VIII Polyphyllin I DTP3 BI-78D3 Bentamapimod (AS602801) |
Cultivo celular, tratamiento y concentración de trabajo
| Líneas celulares | Tipo de ensayo | Concentración | Tiempo de incubación | Formulación | Descripción de la actividad | PMID |
|---|---|---|---|---|---|---|
| human HeLa cells | Function assay | 1 h | Inhibition of JNK3-mediated c-jun phosphorylation in human HeLa cells after 1 hr incubation, IC50=0.486 μM | 25415535 | ||
| human A375 cells | Function assay | 1 h | Inhibition of JNK3-mediated c-jun phosphorylation in human A375 cells after 1 hr incubation, IC50=0.338 μM | 25415535 | ||
| Haga clic para ver más datos experimentales de líneas celulares | ||||||
Información química, almacenamiento y estabilidad
| Peso molecular | 507.59 | Fórmula | C29H29N7O2 |
Almacenamiento (Desde la fecha de recepción) | |
|---|---|---|---|---|---|
| Nº CAS | 1410880-22-6 | Descargar SDF | Almacenamiento de soluciones madre |
|
|
| Sinónimos | JNK Inhibitor XVI | Smiles | CC1=C(C=CC(=C1)NC(=O)C2=CC(=CC=C2)NC(=O)C=CCN(C)C)NC3=NC=CC(=N3)C4=CN=CC=C4 | ||
Solubilidad
|
In vitro |
DMSO
: 100 mg/mL
(197.0 mM)
Water : Insoluble Ethanol : Insoluble |
Calculadora de Molaridad
|
In vivo |
|||||
Calculadora de formulación in vivo (Solución clara)
Paso 1: Introduzca la información a continuación (Recomendado: Un animal adicional para tener en cuenta la pérdida durante el experimento)
Paso 2: Introduzca la formulación in vivo (Esto es solo la calculadora, no la formulación. Por favor, contáctenos primero si no hay una formulación in vivo en la sección de Solubilidad.)
Resultados del cálculo:
Concentración de trabajo: mg/ml;
Método para preparar el líquido maestro de DMSO: mg fármaco predissuelto en μL DMSO ( Concentración del líquido maestro mg/mL, Por favor, contáctenos primero si la concentración excede la solubilidad del DMSO del lote del fármaco. )
Método para preparar la formulación in vivo: Tomar μL DMSO líquido maestro, luego añadirμL PEG300, mezclar y clarificar, luego añadirμL Tween 80, mezclar y clarificar, luego añadir μL ddH2O, mezclar y clarificar.
Método para preparar la formulación in vivo: Tomar μL DMSO líquido maestro, luego añadir μL Aceite de maíz, mezclar y clarificar.
Nota: 1. Por favor, asegúrese de que el líquido esté claro antes de añadir el siguiente disolvente.
2. Asegúrese de añadir el (los) disolvente(s) en orden. Debe asegurarse de que la solución obtenida, en la adición anterior, sea una solución clara antes de proceder a añadir el siguiente disolvente. Se pueden utilizar métodos físicos como el vórtice, el ultrasonido o el baño de agua caliente para ayudar a la disolución.
Mecanismo de acción
| Características |
JNK-IN-8 and JNK-IN-7 are structurally very similar, but whereas the former is a specific covalent inhibitor of JNKs.
|
|---|---|
| Targets/IC50/Ki |
JNK3
(A375 cells) 1 nM
JNK1
(A375 cells) 4.7 nM
JNK2
(A375 cells) 18.7 nM
Kit (V559D,T670I)
(A375 cells) 56 nM
Kit (V559D)
(A375 cells) 92 nM
|
| In vitro |
JNK-IN-8 inhibe la fosforilación de c-Jun en células HeLa y A375 con una EC50 de 486 nM y 338 nM, respectivamente. Este compuesto muestra una mejora drástica en la selectividad y eliminó la unión a IRAK1, PIK3C3, PIP4K2C y PIP5K3. Requiere Cys116 para la inhibición de JNK2. Este químico (10 mM) suprime la fosforilación de c-Jun estimulada por IL-1β en células IL-1R, un sustrato establecido de las JNKs. Se une covalentemente a las isoformas de JNK, causando un pequeño retraso en la movilidad electroforética de las isoformas de JNK. Se ha descubierto que inhibe la quinasa JNK mediante el perfilado de selectividad de quinasas de amplio espectro de una biblioteca de inhibidores de quinasas de acrilamida basados en la estructura utilizando el enfoque KinomeScan. Este compuesto posee una regioquímica distinta de las subestructuras 1,4-dianilina y 1,3-ácido aminobenzoico. Adopta una conformación de unión tipo I en forma de L para acceder a Cys 154, situada hacia el borde del sitio de unión de ATP. |
| Ensayo de quinasa |
Ensayo de Cinética de Unión
|
|
Ensayo de cinética de unión Las células A375 se pretratan con 1 μM de JNK-IN-8 durante los tiempos indicados. Se retira el medio y se lava tres veces con PBS. Se resuspende el sedimento celular con 1 mL de tampón de lisis (1% NP-40, 1% CHAPS, 25 mM Tris, 150 mM NaCl, cóctel de inhibidores de fosfatasa y cóctel de inhibidores de proteasa). Se rota de extremo a extremo durante 30 min a 4℃. Los lisados se clarifican mediante centrifugación a 1,4×104 rpm durante 15 min en el Eppendorf. Los lisados clarificados se filtran en gel en tampón de quinasa (0,1% NP-40, 20 mM HEPES, 150 mM NaCl, cóctel de inhibidores de fosfatasa, cóctel de inhibidores de proteasa) utilizando columnas 10DG. La concentración total de proteína del lisado filtrado en gel debe ser de alrededor de 5–15 mg/ml. El lisado celular se marca con la sonda de ActivX a 5 μM durante 1 hora. Las muestras se reducen con DTT, y las cisteínas se bloquean con yodoacetamida y se filtran en gel para eliminar el exceso de reactivos e intercambiar el tampón. Se añade 1 volumen de 2× tampón de unión (2% Triton-100, 1% NP-40, 2 mM EDTA, 2× PBS) y 50 μL de suspensión de perlas de estreptavidina, y se rota de extremo a extremo durante 2 horas, se centrifuga a 7.000 rpm durante 2 min. Se lava tres veces con 1× tampón de unión y tres veces con PBS. Se añaden 30 μL de 1× tampón de muestra a las perlas; se calientan las muestras a 95℃ durante 10 min. Se corren las muestras en un gel SDS-PAGE a 110V. Después de la transferencia, la membrana se inmunotransfiere con anticuerpo JNK.
|
|
| In vivo |
JNK-IN-8 es un potente inhibidor de JNK que se dirige específicamente a la activación de JNK. Tiene actividad antifúngica. |
Referencias |
|
Aplicaciones
| Métodos | Biomarcadores | Imágenes | PMID |
|---|---|---|---|
| Western blot | Notch1 / c-Myc / Cyclin D1 / p21 c-Jun / p-c-Jun / ATF2 / p-ATF2 / Elk-1 / pElk-1 |

|
27941886 |
| Growth inhibition assay | Cell viability |
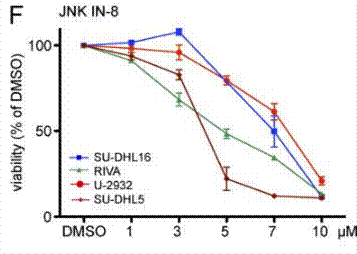
|
25847947 |
Soporte técnico
Tel: +1-832-582-8158 Ext:3
Si tiene alguna otra consulta, por favor deje un mensaje.
