Datos técnicos
| Fórmula | C29H29N7O2 |
||||||
| Peso molecular | 507.59 | Número CAS | 1410880-22-6 | ||||
| Solubilidad (25°C)* | In vitro | DMSO | 100 mg/mL (197.0 mM) | ||||
| Water | Insoluble | ||||||
| Ethanol | Insoluble | ||||||
| In vivo (Agregue los solventes al producto individualmente y en orden.) |
|
||||||
|
* <1 mg/ml significa ligeramente soluble o insoluble. * Tenga en cuenta que Selleck prueba la solubilidad de todos los compuestos internamente, y la solubilidad real puede diferir ligeramente de los valores publicados. Esto es normal y se debe a ligeras variaciones entre lotes. * Envío a temperatura ambiente (Las pruebas de estabilidad demuestran que este producto se puede enviar sin medidas de refrigeración.) |
|||||||
Preparación de soluciones madre
Actividad biológica
| Descripción | JNK-IN-8 (JNK Inhibitor XVI) es el primer inhibidor irreversible de JNK para JNK1, JNK2 y JNK3 con una IC50 de 4,7 nM, 18,7 nM y 1 nM, una selectividad >10 veces mayor contra MNK2, Fms y ninguna inhibición de c-Kit, Met, PDGFRβ en la línea celular A375. | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Objetivos |
|
||||||||||
| In vitro | JNK-IN-8 inhibe la fosforilación de c-Jun en células HeLa y A375 con una EC50 de 486 nM y 338 nM, respectivamente. Este compuesto muestra una mejora drástica en la selectividad y eliminó la unión a IRAK1, PIK3C3, PIP4K2C y PIP5K3. Requiere Cys116 para la inhibición de JNK2. Este químico (10 mM) suprime la fosforilación de c-Jun estimulada por IL-1β en células IL-1R, un sustrato establecido de las JNKs. Se une covalentemente a las isoformas de JNK, causando un pequeño retraso en la movilidad electroforética de las isoformas de JNK. Se ha descubierto que inhibe la quinasa JNK mediante el perfilado de selectividad de quinasas de amplio espectro de una biblioteca de inhibidores de quinasas de acrilamida basados en la estructura utilizando el enfoque KinomeScan. Este compuesto posee una regioquímica distinta de las subestructuras 1,4-dianilina y 1,3-ácido aminobenzoico. Adopta una conformación de unión tipo I en forma de L para acceder a Cys 154, situada hacia el borde del sitio de unión de ATP. |
||||||||||
| In vivo | JNK-IN-8 es un potente inhibidor de JNK que se dirige específicamente a la activación de JNK. Tiene actividad antifúngica. |
||||||||||
| Características | JNK-IN-8 y JNK-IN-7 son estructuralmente muy similares, pero mientras que el primero es un inhibidor covalente específico de JNKs. |
Protocolo (de referencia)
| Ensayo de quinasa: |
|
|---|---|
| Estudio en animales: |
|
Referencias
|
Validación de productos por parte del cliente
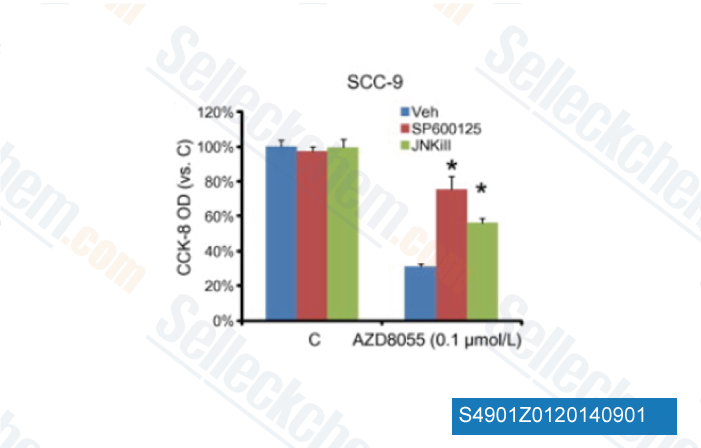
-
Datos de [ Biochem Biophys Res Commun , 2013 , 440(4), 701-6 ]
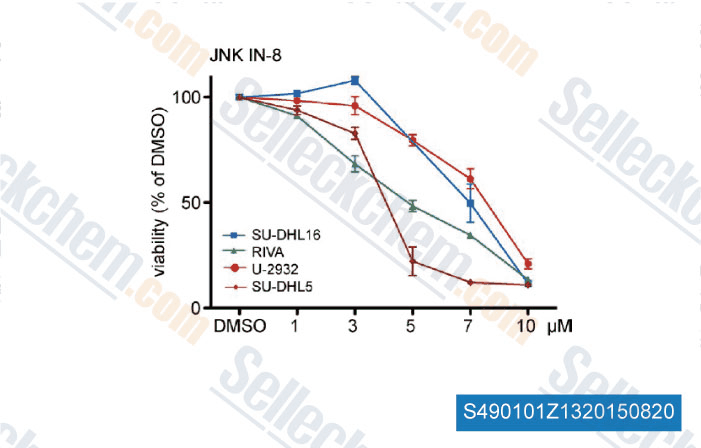
-
Datos de [ , , J Exp Med, 2015, 212(5): 775-92 ]
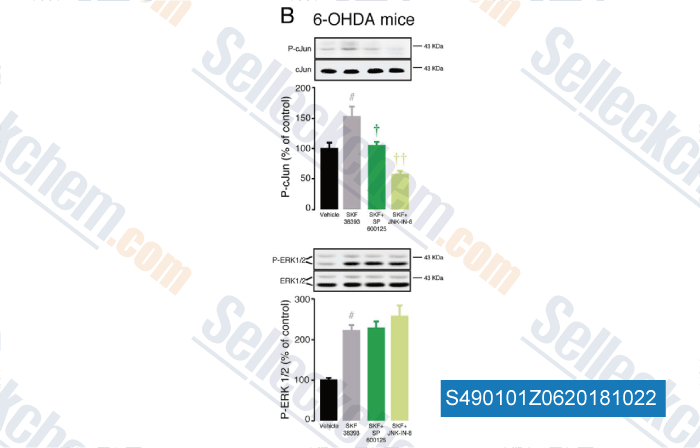
-
Datos de [ , , Neurobiol Dis, 2018, 110:37-46 ]
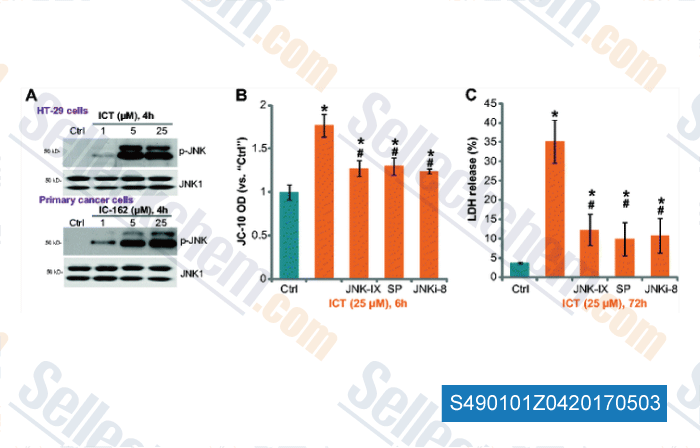
-
Datos de [ , , Tumour Biol, 2016, 37(3):3135-44 ]
Sellecks JNK-IN-8 Ha sido citado por 102 Publicaciones
| Macropinocytosis maintains CAF subtype identity under metabolic stress in pancreatic cancer [ Cancer Cell, 2025, S1535-6108(25)00271-5] | PubMed: 40712568 |
| Oncogenic RAS induces a distinctive form of non-canonical autophagy mediated by the P38-ULK1-PI4KB axis [ Cell Res, 2025, 10.1038/s41422-025-01085-9] | PubMed: 40055523 |
| Spike-in enhanced phosphoproteomics uncovers synergistic signaling responses to MEK inhibition in colon cancer cells [ Nat Commun, 2025, 16(1):4884] | PubMed: 40419504 |
| SLFN11-mediated ribosome biogenesis impairment induces TP53-independent apoptosis [ Mol Cell, 2025, S1097-2765(25)00042-5] | PubMed: 39909041 |
| Inhibiting JNK and PI3K-Akt signaling pathways altered spontaneous network bursts and developmental trajectories of neuronal networks [ J Neural Eng, 2025, 22(5)] | PubMed: 40897198 |
| L1CAM signaling through planar cell polarity generates SOX2 + metastatic progenitors in lung adenocarcinoma [ bioRxiv, 2025, 2025.08.22.671773] | PubMed: 40894609 |
| [C6TSEDRVAJZ, a combination of small-molecule compounds, induces differentiation of human placental fibroblasts into epithelioid cells in vitro] [ Nan Fang Yi Ke Da Xue Xue Bao, 2025, 45(2):322-330] | PubMed: 40031976 |
| The ribotoxic stress response drives UV-mediated cell death [ Cell, 2024, 187(14):3652-3670.e40] | PubMed: 38843833 |
| Pharmacogenomic profiling of intra-tumor heterogeneity using a large organoid biobank of liver cancer [ Cancer Cell, 2024, 42(4):535-551.e8] | PubMed: 38593780 |
| Reversible covalent c-Jun N-terminal kinase inhibitors targeting a specific cysteine by precision-guided Michael-acceptor warheads [ Nat Commun, 2024, 15(1):8606] | PubMed: 39366946 |
POLÍTICA DE DEVOLUCIÓN
La Política de Devolución Incondicional de Selleck Chemical garantiza una experiencia de compra en línea fluida para nuestros clientes. Si no está satisfecho con su compra de alguna manera, puede devolver cualquier artículo(s) dentro de los 7 días posteriores a su recepción. En caso de problemas de calidad del producto, ya sean problemas relacionados con el protocolo o con el producto, puede devolver cualquier artículo(s) dentro de los 365 días a partir de la fecha de compra original. Siga las instrucciones a continuación al devolver productos.
ENVÍO Y ALMACENAMIENTO
Los productos Selleck se transportan a temperatura ambiente. Si recibe el producto a temperatura ambiente, tenga la seguridad de que el Departamento de Inspección de Calidad de Selleck ha realizado experimentos para verificar que la colocación a temperatura normal durante un mes no afectará la actividad biológica de los productos en polvo. Después de la recogida, guarde el producto de acuerdo con los requisitos descritos en la hoja de datos. La mayoría de los productos Selleck son estables en las condiciones recomendadas.
NO PARA USO HUMANO, DIAGNÓSTICO VETERINARIO O TERAPÉUTICO.
