solo para uso en investigación
Decitabine DNA Methyltransferase inhibidor
Cat. No.S1200
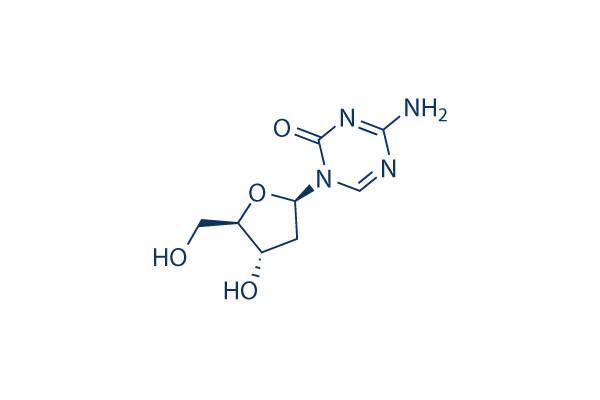
Estructura química
Peso molecular: 228.21
Control de calidad
| Dianas relacionadas | HDAC JAK BET Histone Methyltransferase PKC PARP HIF PRMT EZH2 AMPK |
|---|---|
| Otros DNA Methyltransferase Inhibidores | RG108 SGI-1027 Zebularine (NSC 309132) GSK3685032 Gamma-Oryzanol CM272 β-thujaplicin Bobcat339 DC-05 2'-Deoxy-5-Fluorocytidine |
Cultivo celular, tratamiento y concentración de trabajo
| Líneas celulares | Tipo de ensayo | Concentración | Tiempo de incubación | Formulación | Descripción de la actividad | PMID |
|---|---|---|---|---|---|---|
| Eca109 | Function Assay | 0.5 μM | 24 h | water | modulates the gene expression of MAGE-A members | 25123082 |
| Eca109 | Growth Inhibition Assay | 0.5/2.5/5 μM | 24/48/72 h | water | inhibits cell growth in both dose- and time- dependent manner | 25123082 |
| Eca109 | Function Assay | 0.5 μM | 6/12/24 h | water | inhibits cell migration | 25123082 |
| Eca109 | Function Assay | 0.5 μM | 24 h | water | inhibits cell invasion | 25123082 |
| Eca109 | Growth Inhibition Assay | 0.5 μM | 24 h | water | induces G2/M arrest in the cell cycle | 25123082 |
| Eca109 | Function Assay | 0.5/1 μM | 24 h | water | decreases expression of NF-κB2 and MMP2 | 25123082 |
| SW1116 | Growth Inhibition Assay | 0.5/1/2/5 μM | 48 h | DMSO | enhances the Gefitinib induced cell inhibition | 24874286 |
| LOVO | Growth Inhibition Assay | 0.5/1/2/5 μM | 48 h | DMSO | enhances the Gefitinib induced cell inhibition | 24874286 |
| SW1116 | Function Assay | 10 μM | 48 h | DMSO | increases the effective at inhibiting AKT and mTOR signaling pathways combined with gefitinib | 24874286 |
| LOVO | Function Assay | 10 μM | 48 h | DMSO | increases the effective at inhibiting AKT and mTOR signaling pathways combined with gefitinib | 24874286 |
| SW1116 | Apoptosis Assay | 10 μM | 48 h | DMSO | enhances Gefitinib-induced apoptosis | 24874286 |
| LOVO | Apoptosis Assay | 10 μM | 48 h | DMSO | enhances Gefitinib-induced apoptosis | 24874286 |
| RPMI-8226 | Apoptosis Assay | 1/2 μM | 48/72/96 h | DMSO | induces cell apoptosis | 24833108 |
| OPM-2 | Apoptosis Assay | 1/2 μM | 72/96/120 h | DMSO | induces cell apoptosis | 24833108 |
| JJN3 | Apoptosis Assay | 0.5/1 μM | 24/48 h | DMSO | induces cell apoptosis | 24833108 |
| NCI-H929 | Apoptosis Assay | 1/2 μM | 72/96/120 h | DMSO | induces cell apoptosis | 24833108 |
| RPMI-8226 | Growth Inhibition Assay | 1/2 μM | 24/48/72 h | DMSO | affects cell cycle progression negatively | 24833108 |
| OPM-2 | Growth Inhibition Assay | 1/2 μM | 24/48/72 h | DMSO | affects cell cycle progression negatively | 24833108 |
| JJN3 | Growth Inhibition Assay | 0.5/1 μM | 24/48/72 h | DMSO | affects cell cycle progression negatively | 24833108 |
| NCI-H929 | Growth Inhibition Assay | 1/2 μM | 24/48/72 h | DMSO | affects cell cycle progression negatively | 24833108 |
| HeLa | Kinase Assay | Ki=1000–5000 μM for hENT1 | 24780098 | |||
| HeLa | Kinase Assay | Ki=5.6 ± 0.5 μM for hENT2 | 24780098 | |||
| HeLa | Kinase Assay | Ki=21.6 ± 3.0 μM for hCNT1 | 24780098 | |||
| HeLa | Kinase Assay | Ki=14.4 ± 4.6 μM for hCNT3 | 24780098 | |||
| NB4 | Function Assay | 2.5/5/7.5/10 μM | 24 h | DMSO | increasea the expression of precursor miR-125a | 24484870 |
| CD4+ CD25− T | Function Assay | 1/5 μM | reduceS global DNA methylation | 24476360 | ||
| BV-173 | Apoptosis Assay | 0.25/0.5/0.75/1 μM | 48/72/96 h | PBS | induces cell apoptosis in both dose- and time- dependent manner | 24423613 |
| ML-1 | Apoptosis Assay | 0.25/0.5/0.75/1 μM | 48/72/96 h | PBS | induces cell apoptosis in both dose- and time- dependent manner | 24423613 |
| HL-60 | Apoptosis Assay | 0.25/0.5/0.75/1 μM | 48/72/96 h | PBS | induces cell apoptosis in both dose- and time- dependent manner | 24423613 |
| KG-1a | Apoptosis Assay | 0.25/0.5/0.75/1 μM | 48/72/96 h | PBS | induces cell apoptosis in both dose- and time- dependent manner | 24423613 |
| BV-173 | Function Assay | 250/500nM | 48 h | PBS | induces delayed and sustained ROS increase | 24423613 |
| CEM | Function Assay | 250/500nM | 48 h | PBS | induces delayed and sustained ROS increase | 24423613 |
| HL-60 | Function Assay | 250/500nM | 48 h | PBS | induces delayed and sustained ROS increase | 24423613 |
| ML-1 | Function Assay | 250/500nM | 48 h | PBS | induces delayed and sustained ROS increase | 24423613 |
| DLD-1 | Function Assay | 250/500nM | 48 h | PBS | do not induces delayed and sustained ROS increase | 24423613 |
| HCT-116 | Function Assay | 250/500nM | 48 h | PBS | do not induces delayed and sustained ROS increase | 24423613 |
| U937-A/E-9/14/18 | Apoptosis Assay | 0.01/0.1/1/10 μM | 48 h | induces cell apoptosis in a dose-dependent manner | 24300456 | |
| HT29 | Growth Inhibition Assay | 72 h | IC50=1400±179 μM | 24172061 | ||
| SW48 | Growth Inhibition Assay | 72 h | IC50=15.2±6.2 μM | 24172061 | ||
| HCT116 | Growth Inhibition Assay | 72 h | IC50=1.7±0.4 μM | 24172061 | ||
| HepG2 | Function Assay | 0.5/1 μM | 24 h | DMSO | up-regulated the relative OCTN2 mRNA and protein expression | 24146874 |
| LS174T | Function Assay | 0.5/1 μM | 24 h | DMSO | lead to an increase of OCTN2 levels | 24146874 |
| HepG2 | Apoptosis Assay | 1/10/100 μM | 7 d | DMSO | induces cell apoptosis in a dose-dependent manner | 24146874 |
| LS174T | Apoptosis Assay | 1/10/100 μM | 7 d | DMSO | induces cell apoptosis in a dose-dependent manner | 24146874 |
| QBC-939 | Apoptosis Assay | 1/10/100 μM | 7 d | DMSO | induces cell apoptosis in a dose-dependent manner | 24146874 |
| U251 | Apoptosis Assay | 1/10/100 μM | 7 d | DMSO | induces cell apoptosis in a dose-dependent manner | 24146874 |
| HL-60 | Growth Inhibition Assay | 1 μM | 48 h | increases G2-phase cell fraction | 24000324 | |
| MDA‑MB‑453 | Function Assay | 0.2/1 μM | 72 h | causes re-expression of claudin 1 | 23844228 | |
| HCC1569 | Function Assay | 0.2/1 μM | 72 h | causes re-expression of claudin 1 | 23844228 | |
| BT‑474 | Function Assay | 0.2/1 μM | 72 h | causes re-expression of claudin 1 | 23844228 | |
| AGS | Apoptosis Assay | 5/10/20/50 μM | 48 h | DMSO | inhibits the cell viability | 23582784 |
| A549 | Apoptosis Assay | 5/10/20/50 μM | 48 h | DMSO | inhibits the cell viability | 23582784 |
| AGS | Growth Inhibition Assay | 5/10/20/50 μM | 48 h | DMSO | induces G2/M phase arrest | 23582784 |
| Kasumi-1 | Apoptosis Assay | 0.5 μM | 48 h | decreases the cell viability co-treated with Tf-NP-sc | 23493348 | |
| OCI-AML3 | Apoptosis Assay | 2.5 μM | 48 h | decreases the cell viability co-treated with Tf-NP-sc | 23493348 | |
| MV4-11 | Apoptosis Assay | 2.5 μM | 48 h | decreases the cell viability co-treated with Tf-NP-sc | 23493348 | |
| NK | Cytotoxity Assay | 0.02-20 μM | 5 d | decreases the cytolytic activity of NK cells at intermediate concentrations resulting in a U-shaped dose–response curve | 23328088 | |
| NK | Apoptosis Assay | 0.02-20 μM | 5 d | decrease NK cell proliferation and viability as the concentration increased | 23328088 | |
| NK | Function Assay | 0.01-20 μM | 5 d | causes hypomethylation of NK cells in a dose–response | 23328088 | |
| MOLT4/DNR | Function Assay | 5 μM | 4 d | reduces ABCB1 mRNA expression | 23060570 | |
| Jurkat/DOX | Function Assay | 5 μM | 4 d | reduces ABCB1 mRNA expression | 23060570 | |
| MOLT4/DNR | Growth Inhibition Assay | 5 μM | 4 d | reduces the IC50 value for daunorubicin sensitivity | 23060570 | |
| Jurkat/DOX | Growth Inhibition Assay | 5 μM | 4 d | reduces the IC50 value for daunorubicin sensitivity | 23060570 | |
| ccRCC | Apoptosis Assay | 0.01-10μM | 72 h | DMSO | has minimal effect on cell proliferation | 22826467 |
| TNBC | Apoptosis Assay | 0.01-10μM | 72 h | DMSO | has minimal effect on cell proliferation | 22826467 |
| A498 | Apoptosis Assay | 0.01-10μM | 72 h | DMSO | induces synergistic responses with romidepsin | 22826467 |
| KIJ265T | Apoptosis Assay | 0.01-10μM | 72 h | DMSO | induces synergistic responses with romidepsin | 22826467 |
| MDA-231 | Apoptosis Assay | 0.01-10μM | 72 h | DMSO | induces synergistic responses with romidepsin | 22826467 |
| BT-20 | Apoptosis Assay | 0.01-10μM | 72 h | DMSO | induces synergistic responses with romidepsin | 22826467 |
| U937 | Growth Inhibition Assay | 5-20 μM | 24/48/72 h | induces a decrease in cell viability in a concentration- and time-dependent manner | 22767021 | |
| HL60 | Growth Inhibition Assay | 5-20 μM | 24/48/72 h | induces a decrease in cell viability in a concentration- and time-dependent manner | 22767021 | |
| U937 | Apoptosis Assay | 15 μM | 24/48/72 h | induces cell apoptosis | 22767021 | |
| HL60 | Apoptosis Assay | 15 μM | 24/48/72 h | induces cell apoptosis | 22767021 | |
| LS411N | Apoptosis Assay | 0.5 μM | 72 h | increases Fas mRNA level | 22461695 | |
| MDA-MB-231 | Apoptosis Assay | 10 μM | 48 h | reduces cell viability in a dose-dependent manner | 21887697 | |
| MCF-7 | Apoptosis Assay | 10 μM | 48 h | reduces cell viability in a dose-dependent manner | 21887697 | |
| A375 | Growth Inhibition Assay | 0.5 μM | 1/5/8 d | inhibits proliferation and induces differentiation of melanoma cells | 21796622 | |
| SKMEL1 | Growth Inhibition Assay | 0.5 μM | 1/5/8 d | inhibits proliferation and induces differentiation of melanoma cells | 21796622 | |
| SKMEL3 | Growth Inhibition Assay | 0.5 μM | 1/5/8 d | inhibits proliferation and induces differentiation of melanoma cells | 21796622 | |
| SKMEL28 | Growth Inhibition Assay | 0.5 μM | 1/5/8 d | inhibits proliferation and induces differentiation of melanoma cells | 21796622 | |
| MeWo | Growth Inhibition Assay | 0.5 μM | 1/5/8 d | inhibits proliferation and induces differentiation of melanoma cells | 21796622 | |
| B16 | Growth Inhibition Assay | 0.5 μM | 1/5/8 d | inhibits proliferation and induces differentiation of melanoma cells | 21796622 | |
| Ly 1 | Growth Inhibition Assay | 24 h | IC50=7.3 μM | 21772049 | ||
| Ly 7 | Growth Inhibition Assay | 24 h | IC50=10.7 μM | 21772049 | ||
| Su-DHL6 | Growth Inhibition Assay | 24 h | IC50>20 μM | 21772049 | ||
| Ly 10 | Growth Inhibition Assay | 24 h | IC50>20 μM | 21772049 | ||
| RIVA | Growth Inhibition Assay | 24 h | IC50>20 μM | 21772049 | ||
| Su-DHL2 | Growth Inhibition Assay | 24 h | IC50>20 μM | 21772049 | ||
| Ly 1 | Growth Inhibition Assay | 48 h | IC50=0.34 μM | 21772049 | ||
| Ly 7 | Growth Inhibition Assay | 48 h | IC50=0.025 μM | 21772049 | ||
| Su-DHL6 | Growth Inhibition Assay | 48 h | IC50>20 μM | 21772049 | ||
| Ly 10 | Growth Inhibition Assay | 48 h | IC50=1.8 μM | 21772049 | ||
| RIVA | Growth Inhibition Assay | 48 h | IC50>20 μM | 21772049 | ||
| Su-DHL2 | Growth Inhibition Assay | 48 h | IC50=17.4 μM | 21772049 | ||
| Ly 1 | Growth Inhibition Assay | 72 h | IC50=0.01 μM | 21772049 | ||
| Ly 7 | Growth Inhibition Assay | 72 h | IC50=0.018 μM | 21772049 | ||
| Su-DHL6 | Growth Inhibition Assay | 72 h | IC50=1.6 μM | 21772049 | ||
| Ly 10 | Growth Inhibition Assay | 72 h | IC50=1.2 μM | 21772049 | ||
| RIVA | Growth Inhibition Assay | 72 h | IC50>20 μM | 21772049 | ||
| Su-DHL2 | Growth Inhibition Assay | 72 h | IC50=11.2 μM | 21772049 | ||
| U373-MAGI | Antiviral assay | 0.25 to 8 uM | 2 to 72 hrs | Antiviral activity against VSV-G pseudotyped HIV-1 NL4-3 infected in human U373-MAGI cells assessed as reduction in U5-gag level at 0.25 to 8 uM after 2 to 72 hrs by qPCR method | 27117260 | |
| U373-MAGI | Antiviral assay | 0.25 to 8 uM | 2 to 72 hrs | Antiviral activity against VSV-G pseudotyped HIV-1 NL4-3 infected in human U373-MAGI cells assessed as reduction in gag level at 0.25 to 8 uM after 2 to 72 hrs by qPCR method | 27117260 | |
| Haga clic para ver más datos experimentales de líneas celulares | ||||||
Información química, almacenamiento y estabilidad
| Peso molecular | 228.21 | Fórmula | C8H12N4O4 |
Almacenamiento (Desde la fecha de recepción) | |
|---|---|---|---|---|---|
| Nº CAS | 2353-33-5 | Descargar SDF | Almacenamiento de soluciones madre |
|
|
| Sinónimos | Deoxycytidine, 5-aza-2'-deoxycytidine, 5-AZA-dC, 5-aza-CdR,NSC 127716 | Smiles | C1C(C(OC1N2C=NC(=NC2=O)N)CO)O | ||
Solubilidad
|
In vitro |
DMSO
: 45 mg/mL
(197.18 mM)
Water : 22.5 mg/mL Ethanol : Insoluble |
Calculadora de Molaridad
|
In vivo |
|||||
Calculadora de formulación in vivo (Solución clara)
Paso 1: Introduzca la información a continuación (Recomendado: Un animal adicional para tener en cuenta la pérdida durante el experimento)
Paso 2: Introduzca la formulación in vivo (Esto es solo la calculadora, no la formulación. Por favor, contáctenos primero si no hay una formulación in vivo en la sección de Solubilidad.)
Resultados del cálculo:
Concentración de trabajo: mg/ml;
Método para preparar el líquido maestro de DMSO: mg fármaco predissuelto en μL DMSO ( Concentración del líquido maestro mg/mL, Por favor, contáctenos primero si la concentración excede la solubilidad del DMSO del lote del fármaco. )
Método para preparar la formulación in vivo: Tomar μL DMSO líquido maestro, luego añadirμL PEG300, mezclar y clarificar, luego añadirμL Tween 80, mezclar y clarificar, luego añadir μL ddH2O, mezclar y clarificar.
Método para preparar la formulación in vivo: Tomar μL DMSO líquido maestro, luego añadir μL Aceite de maíz, mezclar y clarificar.
Nota: 1. Por favor, asegúrese de que el líquido esté claro antes de añadir el siguiente disolvente.
2. Asegúrese de añadir el (los) disolvente(s) en orden. Debe asegurarse de que la solución obtenida, en la adición anterior, sea una solución clara antes de proceder a añadir el siguiente disolvente. Se pueden utilizar métodos físicos como el vórtice, el ultrasonido o el baño de agua caliente para ayudar a la disolución.
Mecanismo de acción
| Targets/IC50/Ki |
DNA methylation
(HL-60, KG1a cells) |
|---|---|
| In vitro |
Decitabine inhibe el crecimiento celular de manera dependiente de la dosis y el tiempo con IC50 de aproximadamente 438 nM y 43,8 nM para exposiciones de 72 horas y 96 horas en células leucémicas HL-60 y KG1a, respectivamente. Un estudio reciente muestra que este compuesto exhibe una alta actividad antiproliferativa y proapoptótica contra el linfoma anaplásico de células grandes (ALCL), e inhibe la captación de [3H]–timidina en células KARPAS-299 con una EC50 de 0,49 μM. |
| Ensayo de quinasa |
ensayo de síntesis de ADN
|
|
La tasa de síntesis de ADN se mide por la incorporación de timidina radiactiva en el ADN. Las células HL-60 y KG1a se suspenden en 2 mL de medio RPMI que contiene 10% de suero fetal en placas de 6 pocillos (35 mm de diámetro) y se incuban con diferentes concentraciones de los fármacos correspondientes durante 48 horas (los fármacos se añaden simultáneamente). A las 48 horas, se añaden 0,5 μCi de [3H] timidina (6,7 Ci/mmol) a cada pocillo y se incuban durante 24 horas adicionales. Las células se colocan en filtros de fibra de vidrio GF/C (2,4 cm de diámetro), se lavan con NaCl frío al 0,9%, ácido tricloroacético frío al 5% y etanol. Los filtros que contienen el ADN se secan, se colocan en líquido de centelleo EcoLite (ICN) y la radioactividad se mide utilizando un contador de centelleo Beckman LS 6000IC. La IC50 se define como la concentración de fármaco que inhibe el 50% de la síntesis de ADN de las líneas celulares leucémicas a partir de la curva dosis-respuesta.
|
|
| In vivo |
En un modelo de xenoinjerto murino ALK+ KARPAS-299, Decitabine a una dosis de 2,5 mg/kg causa un aumento de la apoptosis y una reducción de la proliferación de células tumorales, y también resulta en la desmetilación del supresor tumoral p16INK4A. |
Referencias |
|
Aplicaciones
| Métodos | Biomarcadores | Imágenes | PMID |
|---|---|---|---|
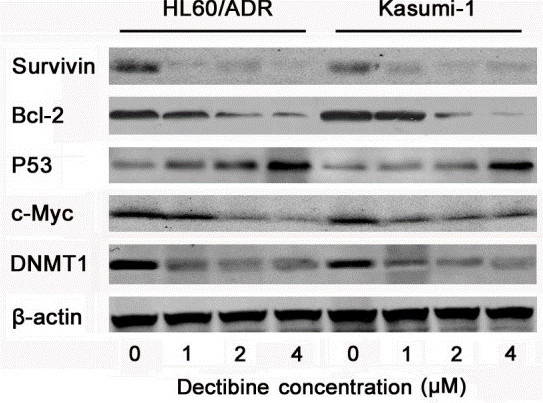
| Western blot | Survivin / Bcl-2 / p53 / c-Myc / DNMT1 p-AKT / AKT / p-GSK3β / GSK3β / p-Myc / Myc / p-P70 / P70 / p-4EBP-1 / 4EBP-1 / PTEN phospho-p38 / p38 / phospho-NFκB / NFκB p-JAK1 / JAK1 / p-JAK2 / JAK2 / p-STAT3 / STAT3 E-cadherin / N-cadherin / Snail / MMP-2 / MMP-9 / Bcl-2 / Bax |
|
26384351 |
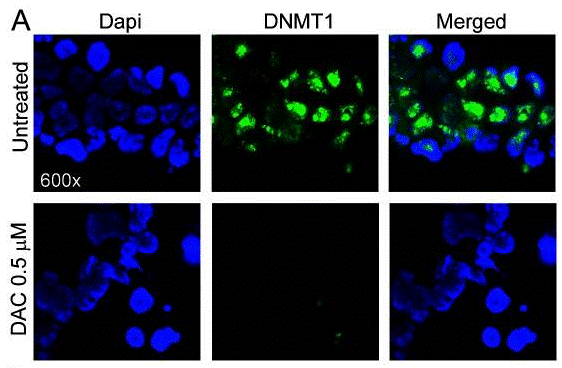
| Immunofluorescence | DNMT1 E-cadherin / MMP-9 |
|
21303982 |
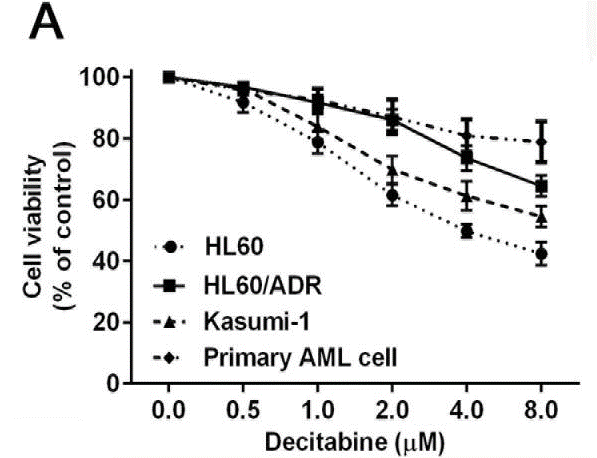
| Growth inhibition assay | Cell viability |
|
26384351 |
Información del ensayo clínico
(datos de https://clinicaltrials.gov, actualizado el 2024-05-22)
| Número NCT | Reclutamiento | Condiciones | Patrocinador/Colaboradores | Fecha de inicio | Fases |
|---|---|---|---|---|---|
| NCT06291285 | Not yet recruiting | Healthy Volunteers |
Novo Nordisk A/S |
February 27 2024 | Phase 1 |
| NCT05960773 | Recruiting | Mesothelioma|Malignant Mesothelioma (MM)|Early-stage Mesothelioma|Subclinical Mesothelioma|BRCA1-Associated Protein-1 (BAP1) Mutations|Early-stage BAP1-associated Malignancies |
National Cancer Institute (NCI)|National Institutes of Health Clinical Center (CC) |
January 31 2024 | Phase 2 |
| NCT05835011 | Terminated | Myelodysplastic Syndromes |
Astex Pharmaceuticals Inc. |
July 14 2023 | Phase 2 |
| NCT05816356 | Recruiting | Healthy |
EpiDestiny Inc.|Worldwide Clinical Trials |
March 24 2023 | Phase 1 |
Soporte técnico
Tel: +1-832-582-8158 Ext:3
Si tiene alguna otra consulta, por favor deje un mensaje.
Preguntas frecuentes
Pregunta 1:
Is it a racemic mixture or a monomer?
Respuesta:
Its S1200 is R form.
