solo para uso en investigación
Fluvastatin Sodium HMG-CoA Reductase inhibidor
Cat. No.S1909
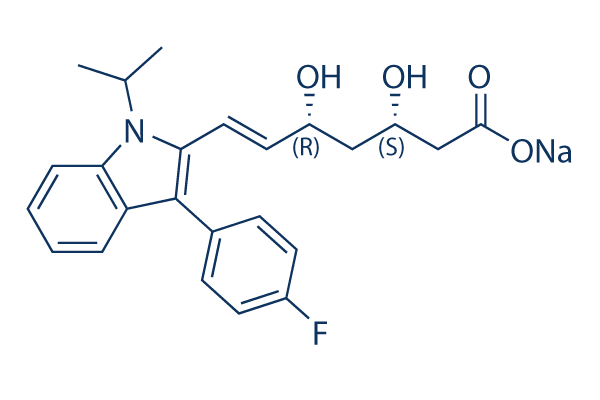
Estructura química
Peso molecular: 433.45
Control de calidad
| Dianas relacionadas | Dehydrogenase HSP Transferase P450 (e.g. CYP17) PDE phosphatase PPAR Vitamin Carbohydrate Metabolism Mitochondrial Metabolism |
|---|---|
| Otros HMG-CoA Reductase Inhibidores | Mevastatin SR-12813 Clinofibrate Dihydrolanosterol 7-ketocholesterol Cerivastatin sodium |
Información química, almacenamiento y estabilidad
| Peso molecular | 433.45 | Fórmula | C24H25FNNaO4 |
Almacenamiento (Desde la fecha de recepción) | |
|---|---|---|---|---|---|
| Nº CAS | 93957-55-2 | Descargar SDF | Almacenamiento de soluciones madre |
|
|
| Sinónimos | XU-62-320 Sodium | Smiles | CC(C)N1C2=CC=CC=C2C(=C1C=CC(CC(CC(=O)[O-])O)O)C3=CC=C(C=C3)F.[Na+] | ||
Solubilidad
|
In vitro |
DMSO
: 87 mg/mL
(200.71 mM)
Water : 18 mg/mL Ethanol : Insoluble |
Calculadora de Molaridad
|
In vivo |
|||||
Calculadora de formulación in vivo (Solución clara)
Paso 1: Introduzca la información a continuación (Recomendado: Un animal adicional para tener en cuenta la pérdida durante el experimento)
Paso 2: Introduzca la formulación in vivo (Esto es solo la calculadora, no la formulación. Por favor, contáctenos primero si no hay una formulación in vivo en la sección de Solubilidad.)
Resultados del cálculo:
Concentración de trabajo: mg/ml;
Método para preparar el líquido maestro de DMSO: mg fármaco predissuelto en μL DMSO ( Concentración del líquido maestro mg/mL, Por favor, contáctenos primero si la concentración excede la solubilidad del DMSO del lote del fármaco. )
Método para preparar la formulación in vivo: Tomar μL DMSO líquido maestro, luego añadirμL PEG300, mezclar y clarificar, luego añadirμL Tween 80, mezclar y clarificar, luego añadir μL ddH2O, mezclar y clarificar.
Método para preparar la formulación in vivo: Tomar μL DMSO líquido maestro, luego añadir μL Aceite de maíz, mezclar y clarificar.
Nota: 1. Por favor, asegúrese de que el líquido esté claro antes de añadir el siguiente disolvente.
2. Asegúrese de añadir el (los) disolvente(s) en orden. Debe asegurarse de que la solución obtenida, en la adición anterior, sea una solución clara antes de proceder a añadir el siguiente disolvente. Se pueden utilizar métodos físicos como el vórtice, el ultrasonido o el baño de agua caliente para ayudar a la disolución.
Mecanismo de acción
| Características |
The order of magnitude of inhibition of each drug on the peroxidation was butylated hydroxytoluene > fluvastatin ≥ probucol ≥ pravastatin.
|
|---|---|
| Targets/IC50/Ki |
HMG-CoA reductase
(Cell-free assay) 8 nM
|
| In vitro |
La Fluvastatin inhibe marcadamente la formación de sustancias reactivas al ácido tiobarbitúrico en la peroxidación de liposomas soportada por hierro (II) con un IC50 de 12 μM. La Fluvastatin, en un rango de 1 μM a 100 μM, inhibe la peroxidación de liposomas mediada por radicales peroxilo inducida por generadores de radicales hidrosolubles y liposolubles, 2,2'-azobis (2-amidinopropano) diclorhidrato y 2,2'-azobis (2,4-dimetilvaleronitrilo), respectivamente. La Fluvastatin (4 mM) y sus metabolitos muestran actividad de captación de aniones superóxido en el sistema hipoxantina-xantina oxidasa y un fuerte efecto de captación sobre el radical hidroxilo producido por la reacción de Fenton. La Fluvastatin (8 μM) y sus metabolitos muestran efectos protectores sobre el daño del ADN tan potentes como los antioxidantes de referencia, el ácido ascórbico, el trolox y el probucol en células CHL/IU. La Fluvastatin (100 nM) muestra una disminución dosis-dependiente en la formación de anión superóxido activada por Ang II en células de músculo liso aórtico humano (hASMC). |
| In vivo |
La Fluvastatin (10 mg/kg/día) da como resultado una disminución de los lípidos séricos en conejos alimentados con una dieta que contiene 1,5% de colesterol. La Fluvastatin (10 mg/kg/día) reduce significativamente la ECA tisular en las aortas de conejos alimentados con una dieta que contiene 1,5% de colesterol. La Fluvastatin (10 mg/kg/día) revierte significativamente la supresión de la relajación inducida por ACh en conejos alimentados con una dieta que contiene 1,5% de colesterol. |
Referencias |
|
Aplicaciones
| Métodos | Biomarcadores | Imágenes | PMID |
|---|---|---|---|
| Growth inhibition assay | Cell viability |
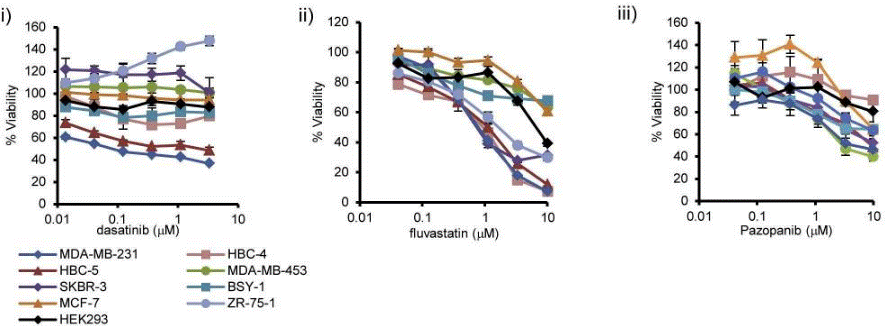
|
26199863 |
| Western blot | p53 / p21 / Cyclin D1 / ATF3 / H3P / PARP / Cleaved PARP / γ-H2AX YAP1 / TAZ / RHAMM |
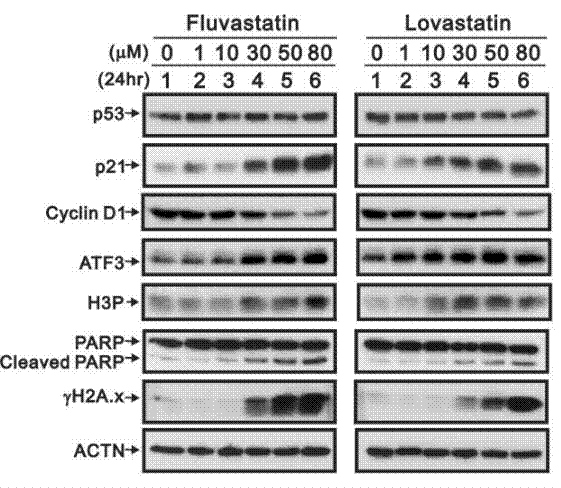
|
30939155 |
| Immunofluorescence | YAP1 |
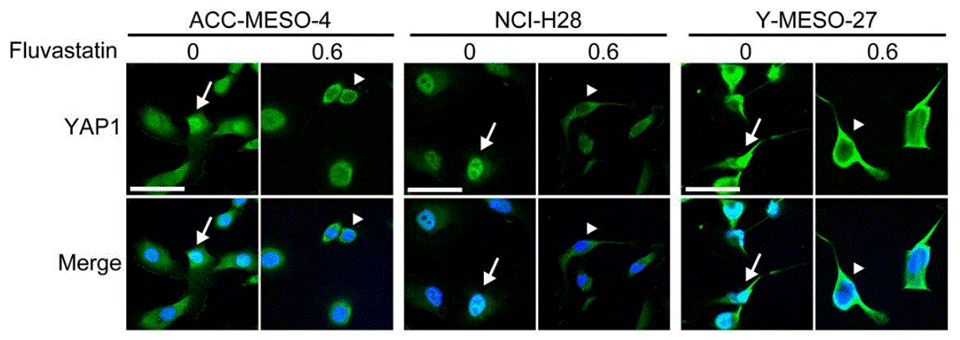
|
29212185 |
Información del ensayo clínico
(datos de https://clinicaltrials.gov, actualizado el 2024-05-22)
| Número NCT | Reclutamiento | Condiciones | Patrocinador/Colaboradores | Fecha de inicio | Fases |
|---|---|---|---|---|---|
| NCT02115074 | Completed | Glioma |
Centre Oscar Lambret|Anticancer Fund Belgium |
June 2014 | Phase 1 |
| NCT01524601 | Completed | Disorder Related to Renal Transplantation|Hypercholesterolemia |
University of Oslo School of Pharmacy|Oslo University Hospital |
February 2012 | Phase 4 |
| NCT00814606 | Withdrawn | Hepatitis C|Hepatitis C Virus |
University of Chicago |
February 2010 | Phase 2 |
| NCT00752843 | Completed | Healthy Subjects |
Corcept Therapeutics |
September 2008 | Phase 1 |
| NCT00674297 | Completed | Antiphospholipid Syndrome |
Hospital for Special Surgery New York|University of Texas |
May 2008 | Phase 2 |
| NCT00404287 | Terminated | Aortic Valve Stenosis |
AORTICA Group |
October 1 2006 | Phase 4 |
Soporte técnico
Tel: +1-832-582-8158 Ext:3
Si tiene alguna otra consulta, por favor deje un mensaje.
