solo para uso en investigación
AC480 (BMS-599626) HER2 inhibidor
Cat. No.S1056
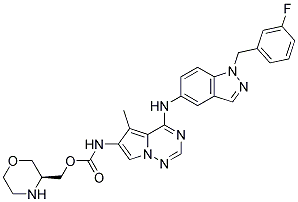
Estructura química
Peso molecular: 530.55
Control de calidad
| Dianas relacionadas | EGFR VEGFR PDGFR FGFR c-Met Src MEK CSF-1R FLT3 c-Kit |
|---|---|
| Otros HER2 Inhibidores | CP-724714 Sapitinib (AZD8931) Mubritinib (TAK 165) Tyrphostin AG 879 HER2-Inhibitor-1 TAS0728 Zongertinib |
Información química, almacenamiento y estabilidad
| Peso molecular | 530.55 | Fórmula | C27H27FN8O3 |
Almacenamiento (Desde la fecha de recepción) | |
|---|---|---|---|---|---|
| Nº CAS | 714971-09-2 | Descargar SDF | Almacenamiento de soluciones madre |
|
|
| Sinónimos | N/A | Smiles | CC1=C2C(=NC=NN2C=C1NC(=O)OCC3COCCN3)NC4=CC5=C(C=C4)N(N=C5)CC6=CC(=CC=C6)F | ||
Solubilidad
|
In vitro |
DMSO
: 113 mg/mL
(212.98 mM)
Ethanol : 20 mg/mL Water : Insoluble |
Calculadora de Molaridad
|
In vivo |
|||||
Calculadora de formulación in vivo (Solución clara)
Paso 1: Introduzca la información a continuación (Recomendado: Un animal adicional para tener en cuenta la pérdida durante el experimento)
Paso 2: Introduzca la formulación in vivo (Esto es solo la calculadora, no la formulación. Por favor, contáctenos primero si no hay una formulación in vivo en la sección de Solubilidad.)
Resultados del cálculo:
Concentración de trabajo: mg/ml;
Método para preparar el líquido maestro de DMSO: mg fármaco predissuelto en μL DMSO ( Concentración del líquido maestro mg/mL, Por favor, contáctenos primero si la concentración excede la solubilidad del DMSO del lote del fármaco. )
Método para preparar la formulación in vivo: Tomar μL DMSO líquido maestro, luego añadirμL PEG300, mezclar y clarificar, luego añadirμL Tween 80, mezclar y clarificar, luego añadir μL ddH2O, mezclar y clarificar.
Método para preparar la formulación in vivo: Tomar μL DMSO líquido maestro, luego añadir μL Aceite de maíz, mezclar y clarificar.
Nota: 1. Por favor, asegúrese de que el líquido esté claro antes de añadir el siguiente disolvente.
2. Asegúrese de añadir el (los) disolvente(s) en orden. Debe asegurarse de que la solución obtenida, en la adición anterior, sea una solución clara antes de proceder a añadir el siguiente disolvente. Se pueden utilizar métodos físicos como el vórtice, el ultrasonido o el baño de agua caliente para ayudar a la disolución.
Mecanismo de acción
| Targets/IC50/Ki |
HER1
20 nM
HER2
30 nM
HER4
190 nM
|
|---|---|
| In vitro |
AC480 (BMS-599626) se identifica como un inhibidor competitivo de ATP para HER1 y como un inhibidor no competitivo de ATP para HER2 con Ki de 2 nM y 5 nM, respectivamente. También inhibe el receptor relacionado HER4, pero con una potencia reducida con IC50 de 190 nM. Este compuesto inhibe la proliferación de células tumorales que expresan altos niveles de HER1 y/o HER2, incluyendo las células Sal2, BT474, N87, KPL-4, HCC202, HCC1954, HCC1419, AU565, ZR-75-30, MDA-MB-175, GEO y PC9 con IC50 de 0,24 μM, 0,31 μM, 0,45 μM, 0,38 μM, 0,94 μM, 0,34 μM, 0,75 μM, 0,63 μM, 0,51 μM, 0,84 μM, 0,90 μM y 0,34 μM, respectivamente. Sin embargo, la proliferación de la línea celular de tumor ovárico A2780 y los fibroblastos MRC5, ninguno de los cuales expresa HER1 o HER2, no se ve significativamente inhibida por él. Un estudio reciente muestra que mejora significativamente la radiosensibilidad de las células HN-5 que expresan tanto EGFR como Her2, al promover la redistribución del ciclo e inhibir la reparación del ADN.
|
| Ensayo de quinasa |
Ensayos de Protein Tyrosine Kinase
|
|
Las secuencias citoplasmáticas completas de HER1, HER2 y HER4 se expresan como proteínas recombinantes en células de insecto Sf9. HER1 y HER4 se expresan como proteínas de fusión con glutatión-S-transferasa y se purifican por cromatografía de afinidad en glutatión-S-Sepharose. HER2 se subclona en el vector pBlueBac4 y se expresa como una proteína sin etiqueta utilizando un codón de metionina interno (M687) para el inicio de la traducción. La proteína HER2 truncada se aísla por cromatografía en una columna de DEAE-Sepharose equilibrada en un tampón que contiene 0,1 M de NaCl, y la proteína recombinante se eluye con un tampón que contiene 0,3 M de NaCl. Para los ensayos de quinasa HER, los volúmenes de reacción son de 50 μL y contienen 10 ng de proteína de fusión de glutatión-S-transferasa o 150 ng de HER2 parcialmente purificada. Las mezclas también contienen 1,5 μM de poli(Glu/Tyr) (4:1), 1 μM de ATP, 0,15 μCi de [γ-33P]ATP, 50 mM de Tris-HCl (pH 7,7), 2 mM de DTT, 0,1 mg/mL de albúmina sérica bovina y 10 mM de MnCl2. Las reacciones se dejan proceder a 27°C durante 1 hora y se terminan con la adición de 10 μL de un tampón de parada (2,5 mg/mL de albúmina sérica bovina y 0,3 M de EDTA), seguido de una mezcla de 108 μL de 3,5 mM de ATP y 5% de ácido tricloroacético. Las proteínas insolubles en ácido se recuperan en placas Unifilter GF/C con un cosechador Filtermate. La incorporación de fosfato radiactivo en el sustrato de poli(Glu/Tyr) se determina por recuento de centelleo líquido. El porcentaje de inhibición de la actividad quinasa se determina mediante análisis de regresión no lineal y los datos se informan como la concentración inhibitoria requerida para lograr el 50% de inhibición en relación con las reacciones de control (IC50). Los datos son los promedios de determinaciones por triplicado. Todas las demás Protein Tyrosine Kinase también se analizan utilizando poli(Glu/Tyr) como sustrato. La cinética de la inhibición de HER1 y HER2 se determina en mezclas de reacción que contienen concentraciones variables de ATP y AC480 (BMS-599626).
|
|
| In vivo |
AC480 (BMS-599626) produce una potente actividad antitumoral en un xenoinjerto de tumor mamario humano KPL-4 a su dosis máxima tolerada de 180 mg/kg, y también tiene una actividad antitumoral similar en otros modelos de xenoinjertos amplificados para HER2, así como en otros modelos de xenoinjertos que sobreexpresan HER1. In vivo, la administración oral de este compuesto resulta en una inhibición dosis-dependiente del crecimiento tumoral Sal2 en dosis que van de 60 mg/kg a 240 mg/kg.
|
Referencias |
|
Información del ensayo clínico
(datos de https://clinicaltrials.gov, actualizado el 2024-05-22)
| Número NCT | Reclutamiento | Condiciones | Patrocinador/Colaboradores | Fecha de inicio | Fases |
|---|---|---|---|---|---|
| NCT01245543 | Withdrawn | Solid Tumors |
Daiichi Sankyo |
November 2010 | Phase 1 |
| NCT00979173 | Completed | Glioma |
Annick Desjardins|Ambit Biosciences Corporation|Duke University |
November 2009 | Phase 1 |
| NCT00093730 | Completed | Unspecified Adult Solid Tumor Protocol Specific |
Jonsson Comprehensive Cancer Center|National Cancer Institute (NCI) |
August 2004 | Phase 1 |
| NCT00095537 | Completed | Cancer|Metastases |
Bristol-Myers Squibb |
March 2004 | Phase 1 |
Soporte técnico
Tel: +1-832-582-8158 Ext:3
Si tiene alguna otra consulta, por favor deje un mensaje.
