solo para uso en investigación
Cinnamaldehyde TRP Channel agonista
Cat. No.S3763
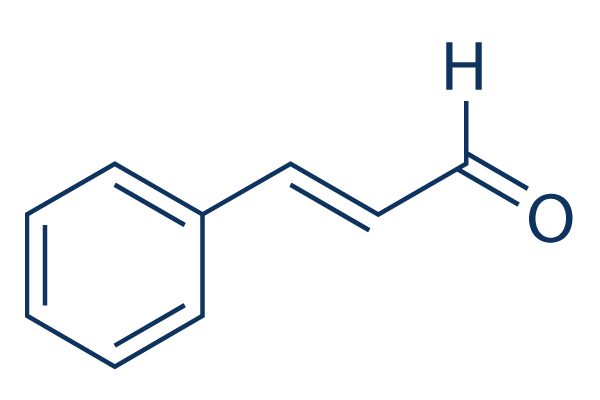
Estructura química
Peso molecular: 132.16
Control de calidad
- Citado en Nature Medicine por su máxima calidad
- COA
- NMR
- SDS
- Hoja de datos
| Dianas relacionadas | CFTR CRM1 CD markers AChR Calcium Channel Sodium Channel Potassium Channel GABA Receptor ATPase GluR |
|---|---|
| Otros TRP Channel Inhibidores | 2-APB (2-Aminoethyl Diphenylborinate) SKF96365 AMG-517 GSK2193874 GSK1016790A HC-030031 Capsazepine EIPA (L593754) SB705498 HC-067047 |
Información química, almacenamiento y estabilidad
| Peso molecular | 132.16 | Fórmula | C9H8O |
Almacenamiento (Desde la fecha de recepción) | 2 years -20°C liquid |
|---|---|---|---|---|---|
| Nº CAS | 14371-10-9 | Descargar SDF | Almacenamiento de soluciones madre |
|
|
Solubilidad
|
In vitro |
|
Calculadora de Molaridad
|
In vivo |
|||||
Calculadora de formulación in vivo (Solución clara)
Paso 1: Introduzca la información a continuación (Recomendado: Un animal adicional para tener en cuenta la pérdida durante el experimento)
Paso 2: Introduzca la formulación in vivo (Esto es solo la calculadora, no la formulación. Por favor, contáctenos primero si no hay una formulación in vivo en la sección de Solubilidad.)
Resultados del cálculo:
Concentración de trabajo: mg/ml;
Método para preparar el líquido maestro de DMSO: mg fármaco predissuelto en μL DMSO ( Concentración del líquido maestro mg/mL, Por favor, contáctenos primero si la concentración excede la solubilidad del DMSO del lote del fármaco. )
Método para preparar la formulación in vivo: Tomar μL DMSO líquido maestro, luego añadirμL PEG300, mezclar y clarificar, luego añadirμL Tween 80, mezclar y clarificar, luego añadir μL ddH2O, mezclar y clarificar.
Método para preparar la formulación in vivo: Tomar μL DMSO líquido maestro, luego añadir μL Aceite de maíz, mezclar y clarificar.
Nota: 1. Por favor, asegúrese de que el líquido esté claro antes de añadir el siguiente disolvente.
2. Asegúrese de añadir el (los) disolvente(s) en orden. Debe asegurarse de que la solución obtenida, en la adición anterior, sea una solución clara antes de proceder a añadir el siguiente disolvente. Se pueden utilizar métodos físicos como el vórtice, el ultrasonido o el baño de agua caliente para ayudar a la disolución.
Mecanismo de acción
| Targets/IC50/Ki |
TRPA1
|
|---|---|
| In vitro |
Cinnamaldehyde (40 μM) podría mejorar la expresión de la lipasa sensible a hormonas (HSL) y suprimir la expresión de perilipina y glicerol-3-fosfato deshidrogenasa, así como reducir la expresión de genes de adipocitos del receptor activado por proliferadores de peroxisomas (PPAR)-γ y la proteína de unión a CCAAT/potenciador-α (CEBP-α) en preadipocitos 3T3-L1. También aumenta la expresión de PPARδ y PPARγ, así como sus genes diana como aP2 y CD36 en adipocitos diferenciados 3T3-L1. El tratamiento con este compuesto aumenta la expresión de GLUT4 a través de la activación del coactivador 1α del receptor γ activado por proliferadores de peroxisomas (PGC-1α) y el desencadenamiento de su efector descendente, los factores potenciadores de miocitos 2 (MEF2) en células C2C12. Su tratamiento regula el metabolismo oxidativo mediante el aumento de las expresiones de la proteína quinasa activada por 5'-adenosín monofosfato (AMPK), la desacetilasa dependiente de NAD+ sirtuina 1, PGC-1α y citocromo C, así como la mejora de la expresión de PPARα y PPARβ/δ, lo que contribuye a la biogénesis mitocondrial. Sin embargo, se demuestra que inhibe el metabolismo mitocondrial al reducir el metabolismo oxidativo basal y el pico inducido químicamente en los miotubos de las células C2C12. Este químico ejerce efectos citotóxicos en las células de leucemia humana K562 al inducir la apoptosis y sinergizar la citotoxicidad de las células CIK contra las células K562.
|
| In vivo |
Cinnamaldehyde exhibe efectos reductores de glucolípidos en animales diabéticos al aumentar la captación de glucosa y mejorar la sensibilidad a la insulina en los tejidos adiposo y muscular esquelético, mejorar la síntesis de glucógeno en el hígado, restaurar la disfunción de los islotes pancreáticos, ralentizar las tasas de vaciamiento gástrico y mejorar los trastornos renales y cerebrales diabéticos. Este compuesto ejerce estos efectos a través de su acción sobre múltiples vías de señalización, incluyendo PPARs, AMPK, PI3K/IRS-1, RBP4-GLUT4, y ERK/JNK/p38MAPK, TRPA1-ghrelin y vías Nrf2. Además, este compuesto parece regular las actividades de PTP1B y α-amilasa. La administración oral de este químico en un rango de 20 mg/kg a 40 mg/kg por día durante un período de 21 a 60 días resulta en una mejora significativa en los niveles de glucosa en sangre y hemoglobina glicosilada (HbA1C), así como la sensibilidad a la insulina en ratas diabéticas inducidas por STZ. No es estable en el cuerpo, con la posibilidad de metabolizarse en ácido cinámico y transformarse en alcohol cinamílico. Dosis excesivas de este compuesto pueden generar una respuesta tóxica. En humanos, el 3% de esta sustancia puede causar irritación cutánea. Se demuestra que disminuye la IL-1β sérica e inhibe la expresión de genes inflamatorios (COX-2, MCP-1, TNF-α e IL-6) en el tejido adiposo blanco (WAT) de ratones albinos suizos machos y C57BLKS db/db tratados con HFD, mientras que el aumento de la expresión de Cpt1a protege contra la liberación de adipocinas proinflamatorias y promueve la oxidación de ácidos grasos, lo que contribuye a una mejora de la resistencia a la insulina.
|
Referencias |
|
Información del ensayo clínico
(datos de https://clinicaltrials.gov, actualizado el 2024-05-22)
| Número NCT | Reclutamiento | Condiciones | Patrocinador/Colaboradores | Fecha de inicio | Fases |
|---|---|---|---|---|---|
| NCT05654298 | Completed | Migraine |
Universitaire Ziekenhuizen KU Leuven |
March 15 2022 | Not Applicable |
| NCT04183283 | Completed | Healthy |
Eli Lilly and Company |
December 12 2019 | Phase 1 |
| NCT04415892 | Unknown status | Chemotherapy-induced Peripheral Neuropathy |
Universitaire Ziekenhuizen KU Leuven |
October 1 2019 | Not Applicable |
Soporte técnico
Tel: +1-832-582-8158 Ext:3
Si tiene alguna otra consulta, por favor deje un mensaje.
