solo para uso en investigación
Tolbutamide (HLS 831) Potassium Channel inhibidor
Cat. No.S2443
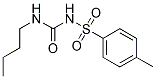
Estructura química
Peso molecular: 270.35
Control de calidad
- Citado en Nature Medicine por su máxima calidad
- COA
- NMR
- SDS
- Hoja de datos
| Dianas relacionadas | CFTR CRM1 CD markers AChR Calcium Channel Sodium Channel GABA Receptor TRP Channel ATPase GluR |
|---|---|
| Otros Potassium Channel Inhibidores | TRAM-34 Nicorandil ML133 HCl Sophocarpine Hydralazine HCl Nigericin Gliquidone E-4031 dihydrochloride PAP-1 Ajmaline |
Información química, almacenamiento y estabilidad
| Peso molecular | 270.35 | Fórmula | C12H18N2O3S |
Almacenamiento (Desde la fecha de recepción) | |
|---|---|---|---|---|---|
| Nº CAS | 64-77-7 | Descargar SDF | Almacenamiento de soluciones madre |
|
|
| Sinónimos | N/A | Smiles | CCCCNC(=O)NS(=O)(=O)C1=CC=C(C=C1)C | ||
Solubilidad
|
In vitro |
DMSO
: 54 mg/mL
(199.74 mM)
Ethanol : 54 mg/mL Water : Insoluble |
Calculadora de Molaridad
|
In vivo |
|||||
Calculadora de formulación in vivo (Solución clara)
Paso 1: Introduzca la información a continuación (Recomendado: Un animal adicional para tener en cuenta la pérdida durante el experimento)
Paso 2: Introduzca la formulación in vivo (Esto es solo la calculadora, no la formulación. Por favor, contáctenos primero si no hay una formulación in vivo en la sección de Solubilidad.)
Resultados del cálculo:
Concentración de trabajo: mg/ml;
Método para preparar el líquido maestro de DMSO: mg fármaco predissuelto en μL DMSO ( Concentración del líquido maestro mg/mL, Por favor, contáctenos primero si la concentración excede la solubilidad del DMSO del lote del fármaco. )
Método para preparar la formulación in vivo: Tomar μL DMSO líquido maestro, luego añadirμL PEG300, mezclar y clarificar, luego añadirμL Tween 80, mezclar y clarificar, luego añadir μL ddH2O, mezclar y clarificar.
Método para preparar la formulación in vivo: Tomar μL DMSO líquido maestro, luego añadir μL Aceite de maíz, mezclar y clarificar.
Nota: 1. Por favor, asegúrese de que el líquido esté claro antes de añadir el siguiente disolvente.
2. Asegúrese de añadir el (los) disolvente(s) en orden. Debe asegurarse de que la solución obtenida, en la adición anterior, sea una solución clara antes de proceder a añadir el siguiente disolvente. Se pueden utilizar métodos físicos como el vórtice, el ultrasonido o el baño de agua caliente para ayudar a la disolución.
Mecanismo de acción
| Targets/IC50/Ki |
Potassium channel
|
|---|---|
| In vitro |
Tolbutamide pertenece a una clase de medicamentos llamados sulfonilureas. Tolbutamide reduce el azúcar en la sangre al hacer que el páncreas produzca insulina (una sustancia natural necesaria para descomponer el azúcar en el cuerpo) y ayudar al cuerpo a usar la insulina de manera eficiente. Este medicamento solo ayudará a reducir el azúcar en la sangre en personas cuyos cuerpos producen insulina de forma natural. Tolbutamide no se usa para tratar la diabetes tipo 1 (una condición en la que el cuerpo no produce insulina y, por lo tanto, no puede controlar la cantidad de azúcar en la sangre) o la cetoacidosis diabética (una condición grave que puede ocurrir si no se trata el nivel alto de azúcar en la sangre). Tolbutamide inhibe tanto las actividades de la proteína quinasa basal como las estimuladas por el AMP cíclico y la IC50 de Tolbutamide es de 4 mM. Se requieren concentraciones similares de Tolbutamide para la inhibición semimáxima de la lipólisis in vitro inducida por hormonas (norepinefrina y ACTH) o por dibutil-AMP cíclico más teofilina. Tolbutamide también inhibe tanto la proteína quinasa soluble como la unida a la membrana del corazón canino. La inhibición por Tolbutamide de la proteína quinasa dependiente de AMP cíclico del tejido adiposo es una posible explicación de los efectos antilipolíticos de este fármaco. Tolbutamide inhibe la proliferación de células de glioma C6 al aumentar Cx43, lo que se correlaciona con una reducción en la fosforilación de pRb debido a la regulación positiva de los inhibidores de Cdk p21 y p27. Los nucleótidos citosólicos mejoran la sensibilidad a Tolbutamide del canal K+ dependiente de ATP en las células B pancreáticas de ratón mediante sus acciones combinadas en receptores inhibidores y estimuladores. Tolbutamide inhibe la fosforilación de la proteína enzimática bifuncional inducida por glucagón de manera dosis-dependiente. Al añadir 2 mM de Tolbutamide, la reducción de la actividad de 6PF-2-K y el aumento de la actividad de Fru-2,6-P2ase en presencia de 10(-9) M de glucagón se restauran parcialmente. Los presentes resultados sugieren la posibilidad de que Tolbutamide module la actividad de la 6PF-2-K/Fru-2,6-P2ase hepática al inhibir una fosforilación de la proteína enzimática.
|
| Ensayo de quinasa |
Ensayo de la quinasa de AMPc
|
|
Las almohadillas de grasa epididimal cortadas de ratas Wistar alimentadas (175-225 g) se obtienen después de la decapitación y se incuban a 37 °C durante dos horas en tampón de Krebs-bicarbonato que contiene 1,27 mM de CaCl2. Cuando se añade, Tolbutamide está presente solo durante la incubación. Después de la incubación, las almohadillas de grasa se enjuagan y se sonicaron en tampón de Krebs-bicarbonato frío. Los sobrenadantes acuosos de la centrifugación a 50 000 × g durante 30 minutos a 4 °C contenían 0,75 a 1,25 mg de proteína por ml y se analizaron para la actividad de la proteína quinasa estimulada por AMP cíclico. El ensayo se realiza en 0,2 ml con estas adiciones: 10 μmoles de glicerofosfato de sodio pH 7,0, 2 μmoles de fluoruro de sodio, 0,4 μmoles de teofilina, 0,1 μmoles de etilenglicol bis (β-aminoetil éter)-N, N'-tetraacético, 3 μmoles de cloruro de magnesio, 0,3 mg de histona mixta, 2 nmoles de (γ-32P) ATP, 1 nmol de AMP cíclico cuando se indica, y 0,05 ml de sobrenadante.
|
|
| In vivo |
450 mg de Tolbutamide/kg/día administrados durante 7 días aumentan significativamente la unión de insulina a adipocitos aislados. Las curvas de unión reflejan un aumento en el número de sitios receptores en lugar de la afinidad. El efecto está asociado con una respuesta mejorada a la insulina del tejido adiposo, ya que las células grasas obtenidas de animales tratados con Tolbutamide convierten significativamente más glucosa en lípidos en presencia de insulina que las obtenidas del grupo de control. Sin embargo, el aumento de los sitios de unión a insulina se observa solo con una gran dosis de tolbutamide, lo que reduce el contenido de insulina pancreática, la respuesta secretora del páncreas aislado y los niveles de insulina sérica. Dosis más pequeñas, suficientes para producir efectos metabólicos a través de una estimulación de la secreción de insulina, no proporcionan sitios de unión a insulina adicionales.
|
Referencias |
|
Información del ensayo clínico
(datos de https://clinicaltrials.gov, actualizado el 2024-05-22)
| Número NCT | Reclutamiento | Condiciones | Patrocinador/Colaboradores | Fecha de inicio | Fases |
|---|---|---|---|---|---|
| NCT05830799 | Completed | Drug Interaction |
Vicore Pharma AB |
March 29 2023 | Phase 1 |
| NCT05097716 | Completed | Healthy Volunteers |
Pfizer |
November 2 2021 | Phase 1 |
| NCT03291288 | Completed | Drug Interaction Potential |
Daiichi Sankyo |
February 26 2018 | Phase 1 |
| NCT02819102 | Completed | Hereditary Angioedema |
BioCryst Pharmaceuticals |
March 2016 | Phase 1 |
Soporte técnico
Tel: +1-832-582-8158 Ext:3
Si tiene alguna otra consulta, por favor deje un mensaje.
