solo para uso en investigación
SH-4-54 STAT inhibidor
Cat. No.S7337
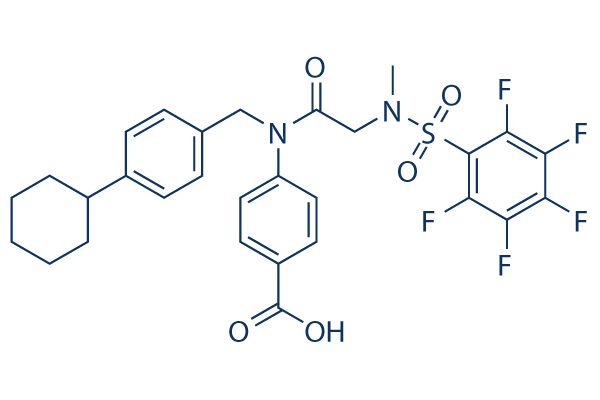
Estructura química
Peso molecular: 610.59
Control de calidad
| Dianas relacionadas | EGFR JAK Pim |
|---|---|
| Otros STAT Inhibidores | Napabucasin (BBI608) Stattic NSC 74859 (S3I-201) Cryptotanshinone (Tanshinone C) C188-9 (TTI-101) BP-1-102 AS1517499 Nifuroxazide HO-3867 Homoharringtonine (HHT) |
Cultivo celular, tratamiento y concentración de trabajo
| Líneas celulares | Tipo de ensayo | Concentración | Tiempo de incubación | Formulación | Descripción de la actividad | PMID |
|---|---|---|---|---|---|---|
| 127EF | Cytotoxicity assay | 3 days | Cytotoxicity against human 127EF cells assessed as cell viability after 3 days by Alamar Blue assay, IC50=0.066μM. | 24900612 | ||
| 30M | Cytotoxicity assay | 3 days | Cytotoxicity against human 30M cells assessed as cell viability after 3 days by Alamar Blue assay, IC50=0.1μM. | 24900612 | ||
| 84EF | Cytotoxicity assay | 3 days | Cytotoxicity against human 84EF cells assessed as cell viability after 3 days by Alamar Blue assay, IC50=0.102μM. | 24900612 | ||
| 67EF | Cytotoxicity assay | 3 days | Cytotoxicity against human 67EF cells assessed as cell viability after 3 days by Alamar Blue assay, IC50=0.106μM. | 24900612 | ||
| 73EF | Cytotoxicity assay | 3 days | Cytotoxicity against human 73EF cells assessed as cell viability after 3 days by Alamar Blue assay, IC50=0.162μM. | 24900612 | ||
| 25EF | Cytotoxicity assay | 3 days | Cytotoxicity against human 25EF cells assessed as cell viability after 3 days by Alamar Blue assay, IC50=0.234μM. | 24900612 | ||
| 30M | Cytotoxicity assay | 8 days | Cytotoxicity against human 30M cells assessed as cell viability after 8 days by Alamar Blue assay, IC50=0.43μM. | 24900612 | ||
| 73M | Cytotoxicity assay | 8 days | Cytotoxicity against human 73M cells assessed as cell viability after 8 days by Alamar Blue assay, IC50=1.03μM. | 24900612 | ||
| 147EF | Apoptosis assay | 0.1 to 1 uM | 3 hrs | Induction of apoptosis in human 147EF cells assessed as PARP cleavage at 0.1 to 1 uM after 3 hrs by Western blotting analysis | 24900612 | |
| 147EF | Function assay | 0.1 to 1 uM | 3 hrs | Inhibition of AKT phosphorylation in human 147EF cells at 0.1 to 1 uM after 3 hrs by Western blotting analysis | 24900612 | |
| 147EF | Function assay | 0.1 to 1 uM | 3 hrs | Inhibition of STAT3 phosphorylation at Y705 in human 147EF cells at 0.1 to 1 uM after 3 hrs by Western blotting analysis | 24900612 | |
| 73M | Function assay | 1 uM | Inhibition of STAT3 phosphorylation at Y705 in human 73M cells at 1 uM | 24900612 | ||
| 147EF | Function assay | 2 to 72 hrs | Inhibition of STAT3 in human 147EF cells assessed as reduction of phosphorylated Bcl-xL level after 2 to 72 hrs by Western blotting analysis | 24900612 | ||
| 147EF | Function assay | 2 to 72 hrs | Inhibition of STAT3 in human 147EF cells assessed as reduction of phosphorylated cyclin D1 level after 2 to 72 hrs by Western blotting analysis | 24900612 | ||
| BT73 | Function assay | 10 mg/kg | 3 days | In vivo inhibition of STAT3 phosphorylation in tumor of NOD-SCID mouse xenografted with human BT73 cells at 10 mg/kg, ip administered as 4 days on/3 days off schedule measured 2 hrs post last dose | 24900612 | |
| BT73 | Antitumor assay | 10 mg/kg | 3 days | Antitumor activity against human BT73 cells xenografted in NOD-SCID mouse assessed as decrease in tumor size at 10 mg/kg, ip administered as 4 days on/3 days off schedule measured 2 hrs post last dose by hematoxylin/eosin staining | 24900612 | |
| BT73 | Antitumor assay | 10 mg/kg | 3 days | Antitumor activity against human BT73 cells xenografted in NOD-SCID mouse assessed as induction of apoptosis in tumor at 10 mg/kg, ip administered as 4 days on/3 days off schedule measured 2 hrs post last dose by TUNEL assay | 24900612 | |
| BT73 | Antitumor assay | 10 mg/kg | 3 days | Antitumor activity against human BT73 cells xenografted in NOD-SCID mouse assessed as tumor growth inhibition by measuring downregulation of Ki67 protein expression at 10 mg/kg, ip administered as 4 days on/3 days off schedule measured 2 hrs post last dos | 24900612 | |
| Vero | Function assay | Vero cells viability counterscreen for qRT-PCR qHTS assay of selected Zika virus inhibitors | 33229545 | |||
| Haga clic para ver más datos experimentales de líneas celulares | ||||||
Información química, almacenamiento y estabilidad
| Peso molecular | 610.59 | Fórmula | C29H27F5N2O5S |
Almacenamiento (Desde la fecha de recepción) | |
|---|---|---|---|---|---|
| Nº CAS | 1456632-40-8 | Descargar SDF | Almacenamiento de soluciones madre |
|
|
| Sinónimos | N/A | Smiles | CN(CC(=O)N(CC1=CC=C(C=C1)C2CCCCC2)C3=CC=C(C=C3)C(=O)O)S(=O)(=O)C4=C(C(=C(C(=C4F)F)F)F)F | ||
Solubilidad
|
In vitro |
DMSO
: 100 mg/mL
(163.77 mM)
Ethanol : 100 mg/mL Water : Insoluble |
Calculadora de Molaridad
|
In vivo |
|||||
Calculadora de formulación in vivo (Solución clara)
Paso 1: Introduzca la información a continuación (Recomendado: Un animal adicional para tener en cuenta la pérdida durante el experimento)
Paso 2: Introduzca la formulación in vivo (Esto es solo la calculadora, no la formulación. Por favor, contáctenos primero si no hay una formulación in vivo en la sección de Solubilidad.)
Resultados del cálculo:
Concentración de trabajo: mg/ml;
Método para preparar el líquido maestro de DMSO: mg fármaco predissuelto en μL DMSO ( Concentración del líquido maestro mg/mL, Por favor, contáctenos primero si la concentración excede la solubilidad del DMSO del lote del fármaco. )
Método para preparar la formulación in vivo: Tomar μL DMSO líquido maestro, luego añadirμL PEG300, mezclar y clarificar, luego añadirμL Tween 80, mezclar y clarificar, luego añadir μL ddH2O, mezclar y clarificar.
Método para preparar la formulación in vivo: Tomar μL DMSO líquido maestro, luego añadir μL Aceite de maíz, mezclar y clarificar.
Nota: 1. Por favor, asegúrese de que el líquido esté claro antes de añadir el siguiente disolvente.
2. Asegúrese de añadir el (los) disolvente(s) en orden. Debe asegurarse de que la solución obtenida, en la adición anterior, sea una solución clara antes de proceder a añadir el siguiente disolvente. Se pueden utilizar métodos físicos como el vórtice, el ultrasonido o el baño de agua caliente para ayudar a la disolución.
Mecanismo de acción
| Targets/IC50/Ki |
STAT3
(Cell-free assay) 300 nM(Kd)
STAT5
(Cell-free assay) 464 nM(Kd)
|
|---|---|
| In vitro |
SH-4-54 muestra una citotoxicidad sin precedentes en células madre de cáncer cerebral de glioblastoma humano (BTSCs), mientras que no tiene toxicidad en astrocitos fetales humanos. Además, este compuesto suprime eficazmente la fosforilación de STAT3 y sus objetivos transcripcionales posteriores.
|
| Ensayo de quinasa |
Estudios de resonancia de plasmones de superficie (SPR)
|
|
Los experimentos de unión se realizan en un biosensor ProteOn XPR36 a 25 °C utilizando el chip sensor HTE. Las celdas de flujo del chip sensor se cargan con una solución de níquel a 30 μL/min durante 120 s para saturar la superficie Tris-NTA con iones Ni(II). STAT3 y STAT5 purificados con etiqueta His en tampón PBST (PBS con 0,005 % (v/v) Tween-20 y 0,001 % DMSO pH 7,4) se inyectan en el primer y segundo canal del chip respectivamente en dirección vertical a un caudal de 25 μg/μL durante 300 s, lo que alcanzó, en promedio, ~8000 unidades de resonancia (RU). Después de un lavado con tampón PBST, la unión de los inhibidores a las proteínas inmovilizadas se monitoriza inyectando un rango de concentraciones junto con un blanco a un caudal de 100 μL/min durante 200 s para cada una de estas pequeñas moléculas. Cuando se completa la inyección del inhibidor de molécula pequeña, se permite que el tampón de corrida fluya sobre los sustratos inmovilizados para que los inhibidores unidos no específicamente se disocien durante 600 s. Después de la disociación de los inhibidores, la superficie del chip se regenera con una inyección de 1 M NaCl a un caudal de 100 μL/ml durante 18 s. Se utiliza la referencia del canal entre puntos para las correcciones de unión no específica y el canal en blanco utilizado con cada inyección de analito sirvió como doble referencia para corregir una posible deriva de la línea base. Los datos se analizan utilizando el software ProteOn Manager versión 3.1. Se utilizó el modelo de unión de Langmuir 1:1 para determinar los valores de KD.
|
|
| In vivo |
En ratones xenoinjertados ortotópicamente con BT73, SH-4-54 (10 mg/kg i.p.) exhibe permeabilidad BBB, suprime potentemente el crecimiento tumoral del glioma e inhibe pSTAT3.
|
Referencias |
Aplicaciones
| Métodos | Biomarcadores | Imágenes | PMID |
|---|---|---|---|
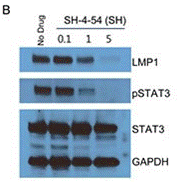
| Western blot | LMP1 / p-STAT3 / STAT3 |
|
28445949 |
Soporte técnico
Tel: +1-832-582-8158 Ext:3
Si tiene alguna otra consulta, por favor deje un mensaje.
