solo para uso en investigación
PNU-120596 AChR modulador
Cat. No.S2629
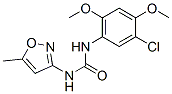
Estructura química
Peso molecular: 311.72
Control de calidad
Información química, almacenamiento y estabilidad
| Peso molecular | 311.72 | Fórmula | C13H14ClN3O4 |
Almacenamiento (Desde la fecha de recepción) | |
|---|---|---|---|---|---|
| Nº CAS | 501925-31-1 | Descargar SDF | Almacenamiento de soluciones madre |
|
|
| Sinónimos | Nsc 216666 | Smiles | CC1=CC(=NO1)NC(=O)NC2=CC(=C(C=C2OC)OC)Cl | ||
Solubilidad
|
In vitro |
DMSO
: 62 mg/mL
(198.89 mM)
Ethanol : 1 mg/mL Water : Insoluble |
Calculadora de Molaridad
|
In vivo |
|||||
Calculadora de formulación in vivo (Solución clara)
Paso 1: Introduzca la información a continuación (Recomendado: Un animal adicional para tener en cuenta la pérdida durante el experimento)
Paso 2: Introduzca la formulación in vivo (Esto es solo la calculadora, no la formulación. Por favor, contáctenos primero si no hay una formulación in vivo en la sección de Solubilidad.)
Resultados del cálculo:
Concentración de trabajo: mg/ml;
Método para preparar el líquido maestro de DMSO: mg fármaco predissuelto en μL DMSO ( Concentración del líquido maestro mg/mL, Por favor, contáctenos primero si la concentración excede la solubilidad del DMSO del lote del fármaco. )
Método para preparar la formulación in vivo: Tomar μL DMSO líquido maestro, luego añadirμL PEG300, mezclar y clarificar, luego añadirμL Tween 80, mezclar y clarificar, luego añadir μL ddH2O, mezclar y clarificar.
Método para preparar la formulación in vivo: Tomar μL DMSO líquido maestro, luego añadir μL Aceite de maíz, mezclar y clarificar.
Nota: 1. Por favor, asegúrese de que el líquido esté claro antes de añadir el siguiente disolvente.
2. Asegúrese de añadir el (los) disolvente(s) en orden. Debe asegurarse de que la solución obtenida, en la adición anterior, sea una solución clara antes de proceder a añadir el siguiente disolvente. Se pueden utilizar métodos físicos como el vórtice, el ultrasonido o el baño de agua caliente para ayudar a la disolución.
Mecanismo de acción
| Targets/IC50/Ki |
α7 nAChR
216 nM(EC50)
|
|---|---|
| In vitro |
PNU-120596 aumenta el flujo de calcio evocado por el agonista (Ach) mediado por una variante modificada del α7 nAChR humano. Este compuesto aumenta las corrientes evocadas por los agonistas (colina y ACh) mediadas por receptores de tipo salvaje y también demuestra una prolongación pronunciada de la respuesta evocada en presencia continua del agonista en ovocitos de Xenopus. Aumenta el tiempo medio de apertura del canal de los α7 nAChRs, pero no tiene efecto sobre la selectividad iónica y relativamente poco, si alguno, efecto sobre la conductancia unitaria. Cuando se aplica a rebanadas agudas de hipocampo, esta sustancia química aumenta la frecuencia de las corrientes postsinápticas GABAérgicas evocadas por ACh medidas en neuronas piramidales; este efecto es suprimido por TTX, lo que sugiere que modula la función de los α7 nAChRs localizados en la membrana somatodendrítica de las interneuronas hipocampales. Además de la modulación positiva al α7 nAChR, este compuesto induce un profundo retraso de la cinética de desensibilización, lo que aumenta el potencial de toxicidad inducida por Ca2+ a través de una estimulación excesiva del α7 nAChR. Causa cambios en la accesibilidad de la cisteína en la lámina beta interna, la zona de transición y el sitio de unión del agonista mientras se une al α7 nAChR. Los sitios de unión para esta sustancia química no se encuentran en los sitios de unión del agonista y mejora el gating de los receptores nicotínicos evocado por el agonista al provocar efectos conformacionales que son similares pero no idénticos a las conformaciones de gating promovidas por Ach.
|
| Ensayo de quinasa |
Ensayo de fluorescencia de Ca2+
|
|
Células epiteliales humanas SH-EP1 que expresan una variante del α7 nAChR (α7*) se cultivan en medio esencial mínimo (MEM) que contiene aminoácidos no esenciales suplementado con 10% de suero bovino fetal, L-glutamina, 100 U/ml de penicilina/estreptomicina, 250 ng/mL de fungizona, 400 μg/mL de higromicina B y 800 μg/mL de geneticina. α7* es una variante del α7 nAChR humano, con dos mutaciones puntuales en el primer dominio transmembrana (T230P y C241S) que permiten una alta expresión funcional en células SH-EP1 [Groppi VE, Wolfe ML, Berkenpas MB (2003) U.S. Patent 6,693,172 B1]. Las células se cultivan en una incubadora a 37 °C con 6% de CO2. Las células se tripsinizan y se siembran en placas de 96 pocillos con paredes laterales oscuras y fondos claros a una densidad de 2 × 104 células/pocillo 2 días antes del análisis. Las células se cargan con una mezcla de Calcium Green-1 AM en dimetilsulfóxido anhidro y 20% de Pluronic F-127. Este reactivo se añade directamente al medio de crecimiento de cada pocillo para alcanzar una concentración final de 2 μM de Calcium Green-1 AM. Luego, las células se incuban en el colorante durante 1 hora a 37 °C y luego se lavan cuatro veces con la solución salina equilibrada de Earle modificada de Mark (MMEBSS) compuesta de lo siguiente (en mM): 4 CaCl2, 0,8 MgSO4, 20 NaCl, 5,3 KCl, 5,6 D-glucosa, 20 Tris-HEPES y 120 N-metil-D-glucamina, pH 7,4. Después del cuarto ciclo, se permite que las células incuben a 37 °C durante al menos 10 minutos. El volumen final de MMEBSS en cada pocillo es de 100 μL y se añade atropina a todos los pocillos para una concentración final de 1 μM. Se configura un lector de placas de imágenes fluorométricas (FLIPR; Molecular Devices, Union City, CA) para excitar el Calcium Green a 488 nm usando 500 mW de potencia y leyendo la emisión de fluorescencia de >525 nm. Se usa una exposición de 0,5 segundos para iluminar cada pocillo. La fluorescencia se detecta usando un juego de diafragmas de 2,0 o 1,2. Después de 30 segundos de registro basal, se añaden los compuestos de prueba a cada pocillo de una placa de 96 pocillos en 50 μL de una solución madre 3 ×. En cada experimento, se utilizan cuatro pocillos como controles de vehículo (0,2% DMSO).
|
|
| In vivo |
La administración sistémica de PNU-120596 (1 mg/kg) a ratas mejora el déficit de filtrado auditivo causado por anfetamina, un modelo propuesto para reflejar una alteración a nivel de circuito asociada con la esquizofrenia. Cuando se administra antes de la carragenina, 30 mg/kg de este compuesto atenúan significativamente la hiperalgesia mecánica y los déficits de carga de peso hasta por 4 horas. Esta sustancia química atenúa el aumento inducido por carragenina en los niveles de TNF-α e IL-6 dentro del edema de la pata trasera, mientras que el diclofenaco solo atenuó los niveles de IL-6. La hiperalgesia mecánica establecida inducida por carragenina o CFA también es parcialmente revertida por este agente.
|
Referencias |
|
Soporte técnico
Tel: +1-832-582-8158 Ext:3
Si tiene alguna otra consulta, por favor deje un mensaje.
