solo para uso en investigación
Benznidazole Parasite inhibidor
Cat. No.S3741
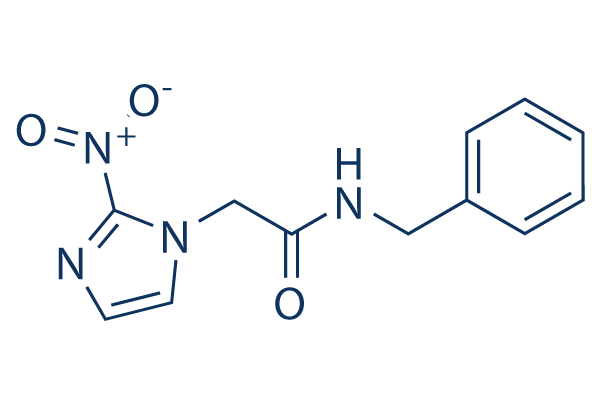
Estructura química
Peso molecular: 260.25
Control de calidad
| Dianas relacionadas | Integrase Bacterial Antibiotics Anti-infection Fungal Antiviral COVID-19 Reverse Transcriptase HIV HCV Protease |
|---|---|
| Otros Parasite Inhibidores | Diminazene Aceturate Oxibendazole Avermectin B1 Oxfendazole Diclazuril Arteether Milbemycin Oxime (+/-)-nerolidol Selamectin Emodepside |
Información química, almacenamiento y estabilidad
| Peso molecular | 260.25 | Fórmula | C12H12N4O3 |
Almacenamiento (Desde la fecha de recepción) | |
|---|---|---|---|---|---|
| Nº CAS | 22994-85-0 | Descargar SDF | Almacenamiento de soluciones madre |
|
|
| Sinónimos | Radanil | Smiles | C1=CC=C(C=C1)CNC(=O)CN2C=CN=C2[N+](=O)[O-] | ||
Solubilidad
|
In vitro |
DMSO
: 52 mg/mL
(199.8 mM)
Ethanol : 5 mg/mL Water : Insoluble |
Calculadora de Molaridad
|
In vivo |
|||||
Calculadora de formulación in vivo (Solución clara)
Paso 1: Introduzca la información a continuación (Recomendado: Un animal adicional para tener en cuenta la pérdida durante el experimento)
Paso 2: Introduzca la formulación in vivo (Esto es solo la calculadora, no la formulación. Por favor, contáctenos primero si no hay una formulación in vivo en la sección de Solubilidad.)
Resultados del cálculo:
Concentración de trabajo: mg/ml;
Método para preparar el líquido maestro de DMSO: mg fármaco predissuelto en μL DMSO ( Concentración del líquido maestro mg/mL, Por favor, contáctenos primero si la concentración excede la solubilidad del DMSO del lote del fármaco. )
Método para preparar la formulación in vivo: Tomar μL DMSO líquido maestro, luego añadirμL PEG300, mezclar y clarificar, luego añadirμL Tween 80, mezclar y clarificar, luego añadir μL ddH2O, mezclar y clarificar.
Método para preparar la formulación in vivo: Tomar μL DMSO líquido maestro, luego añadir μL Aceite de maíz, mezclar y clarificar.
Nota: 1. Por favor, asegúrese de que el líquido esté claro antes de añadir el siguiente disolvente.
2. Asegúrese de añadir el (los) disolvente(s) en orden. Debe asegurarse de que la solución obtenida, en la adición anterior, sea una solución clara antes de proceder a añadir el siguiente disolvente. Se pueden utilizar métodos físicos como el vórtice, el ultrasonido o el baño de agua caliente para ayudar a la disolución.
Mecanismo de acción
| In vitro |
Benznidazole (BZL) inhibe la proliferación de células leucémicas no adherentes controlando el ciclo celular en la fase G0/G1 a través de la regulación al alza de p27. La inhibición del crecimiento inducida por este compuesto es un proceso reversible, no acompañado de una muerte celular significativa. Además de su actividad tripanocida, también tiene un efecto inmunomodulador sobre los macrófagos al bloquear la transcripción de algunos mediadores proinflamatorios sin alterar la expresión de interleucina 10.
|
|---|---|
| In vivo |
En ratones, la administración oral de Benznidazole (100 mg/kg): el tiempo para alcanzar la concentración máxima (Tmax) en plasma fue de 0,83 h, y la concentración máxima (Cmax) en plasma fue de 41,61 μg/ml. La vida media de eliminación (t1/2b) de este compuesto fue de 2,03 h, y el tiempo medio de residencia (MRT) fue de 3,86 h. El volumen de distribución (V) y la depuración (CL), ambos en función de su biodisponibilidad (F), fueron de 38,81 ml y 13,29 ml/h, respectivamente. En ratas Wistar tratadas oralmente, los Tmax de este químico son 2,0 y 1,1 h, respectivamente. Tmax de 15, 30 o 60 min, dependiendo de la dosis, en ratones BALB/c después del tratamiento intraperitoneal y Tmax de 1 a 5 h para perros tratados oralmente. Puede cruzar la barrera hematoencefálica y ejercer su acción en casos de Parasite del sistema nervioso central. Sin embargo, otros estudios han indicado que este compuesto tiene efectos tóxicos en el sistema nervioso central. Los perros tratados oralmente con él presentaron encefalopatía con características multifocales y trastornos clínicos, patológicos y neurológicos que fueron dosis dependientes y tiempo dependientes. Su biodistribución ocurre ampliamente, alcanzando el corazón y el colon, que son los órganos más relevantes para la infección por T. cruzi, y también el bazo, el cerebro, el hígado, los pulmones y los riñones.
|
Referencias |
|
Información del ensayo clínico
(datos de https://clinicaltrials.gov, actualizado el 2024-05-22)
| Número NCT | Reclutamiento | Condiciones | Patrocinador/Colaboradores | Fecha de inicio | Fases |
|---|---|---|---|---|---|
| NCT03892213 | Completed | Chagas Disease |
Drugs for Neglected Diseases|PhinC Development |
October 2014 | Phase 1 |
| NCT01755403 | Completed | Chagas Disease |
Barcelona Centre for International Health Research |
December 2012 | Phase 4 |
| NCT01547533 | Completed | Chagas Disease|Lactation |
Hospital de Niños R. Gutierrez de Buenos Aires |
August 2011 | -- |
| NCT01489228 | Unknown status | Chronic Chagas Disease Indeterminate |
Drugs for Neglected Diseases|Eisai Co. Ltd. |
June 2011 | Phase 2 |
| NCT00699387 | Completed | Chagas Disease |
Hospital de Niños R. Gutierrez de Buenos Aires|Thrasher Research Fund|The Hospital for Sick Children|Fundacion Bunge y Born (Argentina)|Universidad Nacional de La Plata|Consejo de Investigacion en Salud Gobierno de Buenos Aires |
April 2007 | Not Applicable |
Soporte técnico
Tel: +1-832-582-8158 Ext:3
Si tiene alguna otra consulta, por favor deje un mensaje.
