solo para uso en investigación
NH125 CaMK inhibidor
Cat. No.S7436
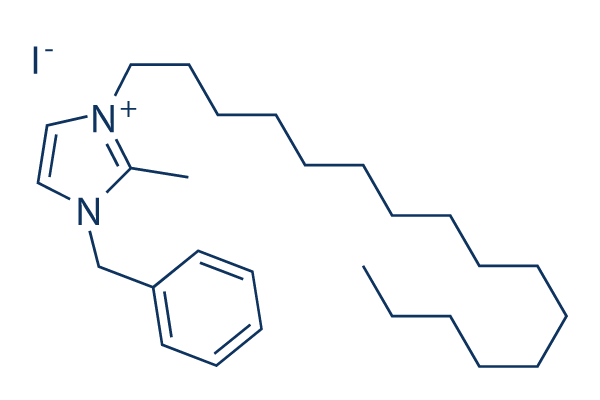
Estructura química
Peso molecular: 524.56
Control de calidad
- Citado en Nature Medicine por su máxima calidad
- COA
- NMR
- SDS
- Hoja de datos
| Dianas relacionadas | Adrenergic Receptor AChR 5-HT Receptor COX Calcium Channel Histamine Receptor Dopamine Receptor GABA Receptor TRP Channel Cholinesterase (ChE) |
|---|---|
| Otros CaMK Inhibidores | KN-93 Phosphate KN-93 STO-609 KN-62 KN-92 phosphate KN-93 hydrochloride |
Información química, almacenamiento y estabilidad
| Peso molecular | 524.56 | Fórmula | C27H45IN2 |
Almacenamiento (Desde la fecha de recepción) | |
|---|---|---|---|---|---|
| Nº CAS | 278603-08-0 | Descargar SDF | Almacenamiento de soluciones madre |
|
|
| Sinónimos | N/A | Smiles | CCCCCCCCCCCCCCCCN1C=C[N+](=C1C)CC2=CC=CC=C2.[I-] | ||
Solubilidad
|
In vitro |
DMSO
: 100 mg/mL
(190.63 mM)
Ethanol : 100 mg/mL Water : Insoluble |
Calculadora de Molaridad
|
In vivo |
|||||
Calculadora de formulación in vivo (Solución clara)
Paso 1: Introduzca la información a continuación (Recomendado: Un animal adicional para tener en cuenta la pérdida durante el experimento)
Paso 2: Introduzca la formulación in vivo (Esto es solo la calculadora, no la formulación. Por favor, contáctenos primero si no hay una formulación in vivo en la sección de Solubilidad.)
Resultados del cálculo:
Concentración de trabajo: mg/ml;
Método para preparar el líquido maestro de DMSO: mg fármaco predissuelto en μL DMSO ( Concentración del líquido maestro mg/mL, Por favor, contáctenos primero si la concentración excede la solubilidad del DMSO del lote del fármaco. )
Método para preparar la formulación in vivo: Tomar μL DMSO líquido maestro, luego añadirμL PEG300, mezclar y clarificar, luego añadirμL Tween 80, mezclar y clarificar, luego añadir μL ddH2O, mezclar y clarificar.
Método para preparar la formulación in vivo: Tomar μL DMSO líquido maestro, luego añadir μL Aceite de maíz, mezclar y clarificar.
Nota: 1. Por favor, asegúrese de que el líquido esté claro antes de añadir el siguiente disolvente.
2. Asegúrese de añadir el (los) disolvente(s) en orden. Debe asegurarse de que la solución obtenida, en la adición anterior, sea una solución clara antes de proceder a añadir el siguiente disolvente. Se pueden utilizar métodos físicos como el vórtice, el ultrasonido o el baño de agua caliente para ayudar a la disolución.
Mecanismo de acción
| Targets/IC50/Ki |
eEF-2 kinase
60 nM
|
|---|---|
| In vitro |
En células de glioma C6, NH125 disminuye el contenido celular de fosfo-eEF-2 sin afectar el contenido total de eEF-2, y bloquea el tránsito del ciclo celular en el límite G1-S. Este compuesto inhibe potentemente la viabilidad celular de 10 células cancerosas con una IC50 que oscila entre 0,7 y 4,8 μM. Inhibe eficazmente las histidina proteína quinasas, incluyendo Envz, PhoQ, BvgS, EvgS, y por lo tanto produce potentes actividades antibacterianas contra Staphylococcus aureus resistente a oxacilina (ORSA), Enterococcus faecalis resistente a vancomicina (VRE), Streptococcus pneumoniae resistente a penicilina (PRS), y otras bacterias Gram-positivas y Gram-negativas. La inhibición de EEF2K por este químico hace que las células tumorales sean más sensibles a la curcumina y al velcade, que poseen acción inductora de estrés del RE.
|
| Ensayo de quinasa |
Ensayo de la eEF-2 Quinasa
|
|
La actividad de la eEF-2 quinasa se mide mediante dos métodos: (a) un ensayo basado en filtro; y (b) por inmunotransferencia utilizando un anticuerpo antifosfo-eEF2. Para ambos, las reacciones se llevan a cabo en 20 μl de volumen total que contiene 50 mM HEPES (pH 7,5), 10 mM MgCl2, 1,5 mM CaCl2, 100 μg/ml de calmodulina, 2 μM de eEF-2 marcado con His y 400 nM de GST-eEF-2 quinasa, y mezcla de ATP [50 μM de ATP con 1 μCi (γ-33P)ATP]. La mezcla de quinasa sin ATP se prepara en hielo y luego se preincuba durante 15 min a temperatura ambiente. Las reacciones de quinasa se inician añadiendo ATP y se dejan progresar a 30°C durante 30 min. Para el ensayo basado en filtro, la reacción se termina añadiendo 20 μl de ácido fosfórico frío al 1,5%, y 5 μl de la reacción se aplican a papel de fosfocelulosa P81 Whatman. El papel se lava tres veces en 500 ml de ácido fosfórico al 0,5% y una vez con 200 ml de acetona. Luego, el papel se seca al aire y se sumerge en 10 ml de mezcla de centelleo. La radioactividad se cuenta usando un contador de centelleo líquido Beckton-Dickinson. Para la inmunotransferencia, las reacciones se detienen añadiendo 20 μl de tampón Lamelli 3× [190 mM Tris (pH 6,8), 6% SDS, 30% glicerol, 15% 2-mercaptoetanol y 0,003% de colorante azul de bromofenol]. Las muestras se hierven durante 5 min y se resuelven mediante SDS-PAGE al 7% y se procesan para Western blotting como se describe a continuación. Las condiciones para ambos ensayos se eligen para asegurar la linealidad de la reacción con respecto al tiempo de incubación y la concentración de la enzima.
|
|
| In vivo |
NH125 reduce la presión arterial en SHR y la producción de ROS, la inducción de moléculas inflamatorias y la hipertrofia en la arteria mesentérica superior de SHR.
|
Referencias |
|
Soporte técnico
Tel: +1-832-582-8158 Ext:3
Si tiene alguna otra consulta, por favor deje un mensaje.
