Solo para uso en investigación
Anti-DYKDDDDK Tag magnetic beads
Las perlas magnéticas Anti-DYKDDDDK Tag se basan en perlas magnéticas de hidroxilo acopladas covalentemente con un anticuerpo monoclonal de ratón recombinante de alta calidad. Con una alta carga de proteína con etiqueta DYKDDDDK (más de 0,6 mg de proteína/ml) y alta especificidad, se recomienda su uso para la co-inmunoprecipitación y purificación de proteínas.

Sellecks Ha sido citado por 119 Publicaciones
Ventajas
Ahorro de tiempo: ahorra 15-30 min en comparación con las perlas de agarosa.
Operación sencilla: Separación magnética y sin centrifugación.
Alta capacidad de carga de proteínas.
Alta especificidad.
Comparación de Productos
Descripción
Las perlas magnéticas Anti-DYKDDDDK Tag se basan en perlas magnéticas de hidroxilo acopladas covalentemente con un anticuerpo monoclonal de ratón recombinante de alta calidad. Con una alta carga de proteína con etiqueta DYKDDDDK (más de 0,6 mg de proteína/ml) y alta especificidad, se recomienda su uso para la co-inmunoprecipitación y purificación de proteínas.
Propiedades
| Isotipo de anticuerpo | Anticuerpo monoclonal recombinante de ratón |
|---|---|
| Purificación de anticuerpos | Purificado con Proteína A |
| Aplicación | Inmunoprecipitación y purificación de proteínas |
| Volumen recomendado | IP: 20 μl de perlas para 200 μl de solución de proteína cruda |
| Capacidad de unión | Mínimo 0,6 mg de proteína eluida por ml de perlas magnéticas |
| Características de unión | Proteína de fusión DYKDDDDK Tag N-terminal Met: Met-DYKDDDDK Tag–Proteína Proteína de fusión DYKDDDDK Tag N-terminal: DYKDDDDK Tag–Proteína Proteína de fusión DYKDDDDK Tag C-terminal: Proteína-DYKDDDDK Tag |
Almacenamiento (desde la fecha de recepción)
Almacenar a 2-8°C durante 2 años.
Protocolo
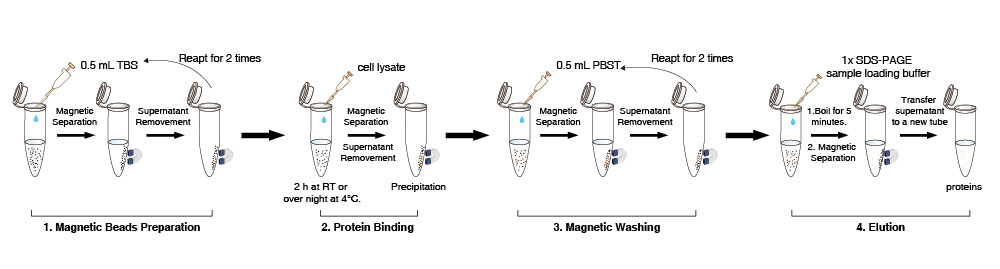
Preparación de perlas magnéticas
1. Suspender las perlas magnéticas Anti-DYKDDDDK Tag en el vial (pipetear suavemente 10 veces, no vortexear). Transferir 10 µL (la cantidad puede aumentarse o disminuirse según sea necesario) de la suspensión de perlas magnéticas Anti-DYKDDDDK Tag a un tubo nuevo.
2. Añadir 0,5 mL de tampón TBS (50 mM Tris HCl, 150 mM NaCl, pH 7,4). Pipetear suavemente 5 veces las perlas magnéticas Anti-DYKDDDDK Tag. Colocar el tubo en el imán para separar las perlas de la solución durante 1-2 min (puede extenderse apropiadamente a 5 minutos) y retirar el sobrenadante. Repetir este paso 2 veces.
Nota: Preparar todas las perlas magnéticas juntas en un tubo grande y luego dividirlas en alícuotas si las muestras están en lotes. Al retirar el sobrenadante, succionar suavemente, ya que una succión excesiva puede resultar en la pérdida de algunas perlas magnéticas.
Unión de proteínas
3. Añadir 500 µL de lisado celular a las perlas magnéticas lavadas. Girar suavemente el tubo durante 2 h a temperatura ambiente o durante la noche a 4°C.
4. Colocar el tubo en el imán para separar las perlas de la solución durante 1-2 min (puede extenderse apropiadamente) y luego transferir el sobrenadante a un tubo nuevo para detectar si queda proteína con etiqueta DYKDDDDK.
Nota: Durante el proceso de unión, no afectará el resultado si las perlas magnéticas se agrupan ocasionalmente.
Lavado magnético
5. Añadir 500 µL de PBST al tubo (NaCl 136,89 mM; KCl 2,67 mM; Na2HPO4 8,1 mM; KH2PO4 1,76 mM; 0,5% Tween20), resuspender las perlas magnéticas pipeteando suavemente. Luego girar el tubo durante 5 min. Colocar el tubo en el imán para separar las perlas de la solución durante 10 seg y retirar el sobrenadante.
6. Repetir el paso 5 unas 2 veces. Si quedan proteínas de impureza no específicas, prolongar el tiempo de limpieza, aumentar el número de lavados o aumentar adecuadamente el contenido de detergente en la solución de limpieza.
Elución y detección
Elegir diferentes métodos de elución según el uso posterior. Para IP, ir a los pasos 7-8. Para purificación de proteínas, ir a los pasos 9-10 para la elución a pH bajo.
Elución desnaturalizante (adecuada para experimentos de IP usando perlas Anti-DYKDDDDK Tag):
7. Para la detección directa de proteínas diana, añadir 50 µL de tampón de carga de muestra 1×proteína en la precipitación mencionada anteriormente, hervir durante 5 min, enfriar a temperatura ambiente y luego colocar el tubo en el imán para separar las perlas de la solución durante 1-2 min (puede extenderse apropiadamente).
8. Detectar el sobrenadante mediante SDS-PAGE.
Elución competitiva de polipéptido poli DYKDDDDK Tag (Adecuada para purificaciones de proteínas con perlas Anti-DYKDDDDK Tag):
9. Añadir el tampón TBS con 200 µg-1 mg/mL de péptido poli DYKDDDDK Tag (B23111) al producto del paso 6, y luego incubarlos en agitador (4°C) durante 2 h. Generalmente, el volumen del péptido poli DYKDDDDK Tag es 5 veces el del gel.
10. Colocar los productos del paso anterior en la separación magnética para la separación magnética. Transferir el sobrenadante que contiene la proteína diana a un nuevo tubo EP. Si se necesitan reutilizar las perlas magnéticas, limpiar el gel con 0,1 M de glicina HCl (pH 3,0) y llevar a cabo el reciclaje.
Elución a pH bajo (Adecuada para purificación de proteínas con perlas Anti-DYKDDDDK Tag):
11. Añadir el tampón de elución 0,1 M glicina HCl (pH 3,0) al producto del paso 6, e incubar en agitador durante 5 min (El tiempo de elución debe ser inferior a 20 min). Generalmente, el volumen del tampón de elución es 5 veces el del gel.
12. Centrifugar los productos obtenidos del paso anterior a 5000 rpm durante 30 seg. Luego transferir el producto de elución rápidamente a 1 M Tris (pH 8,0) para neutralización hasta que el pH sea casi neutro.
Resolución de problemas
| Problema | Razón posible | Mejora sugerida |
|---|---|---|
| Fondo alto | Unión inespecífica de proteínas al anticuerpo, perlas magnéticas o tubos EP | Pre-clarificar el lisado para eliminar las proteínas de unión inespecífica. Después de suspender las perlas para el lavado final, transferir toda la muestra a un tubo EP limpio y luego realizar la separación magnética. |
| Los tiempos de lavado no son suficientes. | Aumentar el número de lavados. Aumentar la duración de los lavados. |
|
| No se observa señal. | La proteína con etiqueta DYKDDDDK no se expresa en la muestra. | Asegurarse de que la proteína de interés contenga la secuencia DYKDDDDK Tag. Preparar el lisado fresco. Usar inhibidores de proteasas apropiados. |
| Los tiempos de incubación son inadecuados. | Aumentar los tiempos de incubación. | |
| Sustancia interferente presente en la muestra. | El lisado puede contener altas concentraciones de ditiotreitol (DTT), 2-mercaptoetanol u otros agentes reductores. La concentración excesiva de detergente puede interferir con la interacción anticuerpo-antígeno. |
Descarga de Archivos
Otros Productos Relacionados
Soporte técnico
Si tiene alguna otra consulta, por favor deje un mensaje.
