uitsluitend voor onderzoeksdoeleinden
LDN-57444 DUB remmer
Cat.Nr.S7135
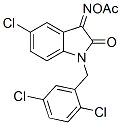
Chemische structuur
Moleculair gewicht: 397.64
Kwaliteitscontrole
| Gerelateerde doelwitten | HDAC Caspase Proteasome Secretase MMP HCV Protease Cysteine Protease DPP Tyrosinase HIV Protease |
|---|---|
| Overige DUB Inhibitoren | PR-619 P5091 IU1 P22077 b-AP15 ML323 VLX1570 TCID EOAI3402143 ML364 |
Chemische informatie, Opslag en Stabiliteit
| Moleculair gewicht | 397.64 | Formule | C17H11Cl3N2O3 |
Opslag (Vanaf de ontvangstdatum) | |
|---|---|---|---|---|---|
| CAS-nr. | 668467-91-2 | SDF downloaden | Opslag van stamoplossingen |
|
|
| Synoniemen | N/A | Smiles | CC(=O)ON=C1C2=C(C=CC(=C2)Cl)N(C1=O)CC3=C(C=CC(=C3)Cl)Cl | ||
Oplosbaarheid
|
In vitro |
DMSO
: 11 mg/mL
(27.66 mM)
Water : Insoluble Ethanol : Insoluble |
Molariteitscalculator
|
In vivo |
|||||
In vivo Formuleringscalculator (Heldere oplossing)
Stap 1: Voer de onderstaande informatie in (Aanbevolen: Een extra dier voor het geval van verlies tijdens het experiment)
Stap 2: Voer de in vivo formulering in (Dit is alleen de calculator, geen formulering. Neem eerst contact met ons op als er geen in vivo formulering is in het gedeelte Oplosbaarheid.)
Berekeningsresultaten:
Werkconcentratie: mg/ml;
Methode voor het bereiden van DMSO-mastervloeistof: mg geneesmiddel vooraf opgelost in μL DMSO ( Concentratie mastervloeistof mg/mL, Neem eerst contact met ons op als de concentratie de DMSO-oplosbaarheid van de partij geneesmiddel overschrijdt. )
Methode voor het bereiden van in vivo formulering: Neem μL DMSO mastervloeistof, voeg vervolgens toeμL PEG300, mengen en helder maken, voeg vervolgens toeμL Tween 80, mengen en helder maken, voeg vervolgens toe μL ddH2O, mengen en helder maken.
Methode voor het bereiden van in vivo formulering: Neem μL DMSO mastervloeistof, voeg vervolgens toe μL Maïsolie, mengen en helder maken.
Opmerking: 1. Zorg ervoor dat de vloeistof helder is voordat u het volgende oplosmiddel toevoegt.
2. Zorg ervoor dat u het/de oplosmiddel(en) in de juiste volgorde toevoegt. U moet ervoor zorgen dat de verkregen oplossing, bij de vorige toevoeging, een heldere oplossing is voordat u verdergaat met het toevoegen van het volgende oplosmiddel. Fysische methoden zoals vortexen, echografie of een warmwaterbad kunnen worden gebruikt om het oplossen te bevorderen.
Werkingsmechanisme
| Targets/IC50/Ki |
UCH-L1
0.4 μM(Ki)
UCH-L1
0.88 μM
UCH-L3
25 μM
|
|---|---|
| In vitro |
Behandeling met 50 μM LDN-57444 gedurende 24 uur leidt tot 70% remming van de proteasoomactiviteit. Deze verbinding veroorzaakt een significante en concentratieafhankelijke afname van de cellevensvatbaarheid bij concentraties boven 25 μM en de cellevensvatbaarheid daalde tot 61,81% bij 50 μM. Het is in staat om celdood te veroorzaken via de apoptoseroute door de activiteit van het ubiquitine-proteasoom-systeem te verlagen en de niveaus van sterk geübiquitineerde eiwitten te verhogen, die beide de ongevouwen eiwitrespons kunnen activeren. De door deze chemische stof geïnduceerde apoptose kan worden geactiveerd door de activering van endoplasmatisch reticulumstress (ERS).
|
| Kinase Assay |
HTS-screening
|
|
Om een test te starten, wordt 0,5 μL van 5 mg/mL testverbinding (ongeveer 50 μM uiteindelijke reactieconcentratie) of DMSO-controle in elk putje gepipetteerd. Zowel enzym als substraat worden bereid in UCH-reactiebuffer (50 mM Tris-HCl [pH 7,6], 0,5 mM EDTA, 5 mM DTT en 0,5 mg/mL ovalbumine). Vervolgens wordt 25 μL van 0,6 nM UCH-L1 aan elk putje toegevoegd, behalve aan de substraatcontroleputjes, gevolgd door 45-60 seconden plaat schudden op een automatische schudder. Het enzym-/verbindingsmengsel wordt 30 minuten bij kamertemperatuur geïncubeerd voordat 25 μL van 200 nM Ub-AMC wordt toegevoegd om de enzymreactie te initiëren. Het reactiemengsel (300 pM UCH-L1, 100 nM Ubiquitine-AMC met 2,5 μg testverbinding) wordt nog 30 minuten bij kamertemperatuur geïncubeerd voordat de reactie wordt geblust door de toevoeging van 10 μL 500 mM azijnzuur per putje. De fluorescentie-emissie-intensiteit wordt gemeten op een LJL Analyst met behulp van een coumarinefilterset (ex = 365 nm, em = 450 nm) en wordt afgetrokken van de intrinsieke fluorescentie van de verbinding om de enzymactiviteit te onthullen. Een DMSO-controle (0,5 μL DMSO, 25 μL UCH-L1, 25 μL ubiquitine-AMC, 10 μL azijnzuur), enzymcontrole (25 μL UCH-L1, 25 μL buffer, 10 μL azijnzuur), substraatcontrole (25 μL buffer, 25 μL ubiquitine-AMC, 10 μL azijnzuur) en remmercontrole (0,5 μL ubiquitine-aldehyde [100 nM stock], 25 μL UCH-L1, 25 μL ubiquitine-AMC, 10 μL azijnzuur) worden ook uitgevoerd in elke testplaat om kwaliteit en reproduceerbaarheid te waarborgen. Potentiële UCH-L1-remmers worden geselecteerd als de verbindingen meer dan 60% remming vertonen in vergelijking met de controles. De UCH-L1 enzymatische reacties worden handmatig twee keer herhaald met behulp van hetzelfde protocol om de resultaten voor de hitverbindingen van de primaire robotgestuurde screening te bevestigen.
|
|
| In vivo |
LDN-57444 veroorzaakt dramatische veranderingen in de synaptische eiwitdistributie en stekelvorm in vivo. Behandeling met deze verbinding resulteert ook in een snelle daling van de Uch-L1-activiteit, maar proteasoomremming heeft geen effect op de cAMP-niveaus gedurende een periode van enkele uren.
|
Referenties |
|
Technische ondersteuning
Tel: +1-832-582-8158 Ext:3
Als u nog andere vragen heeft, kunt u een bericht achterlaten.
