uitsluitend voor onderzoeksdoeleinden
Tiplaxtinin (PAI-039) PAI-1 remmer
Cat.Nr.S7922
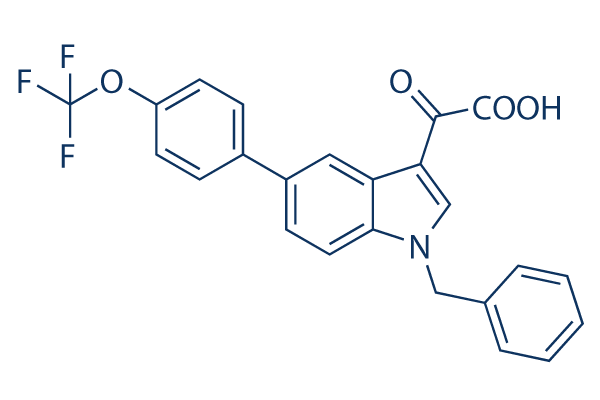
Chemische structuur
Moleculair gewicht: 439.38
Kwaliteitscontrole
| Gerelateerde doelwitten | Dehydrogenase HSP Transferase P450 (e.g. CYP17) PDE phosphatase PPAR Vitamin Carbohydrate Metabolism Mitochondrial Metabolism |
|---|---|
| Overige PAI-1 Inhibitoren | Notoginsenoside R1 Loureirin B Toddalolactone TM5275 Sodium TM5441 |
Chemische informatie, Opslag en Stabiliteit
| Moleculair gewicht | 439.38 | Formule | C24H16F3NO4 |
Opslag (Vanaf de ontvangstdatum) | |
|---|---|---|---|---|---|
| CAS-nr. | 393105-53-8 | SDF downloaden | Opslag van stamoplossingen |
|
|
| Synoniemen | N/A | Smiles | C1=CC=C(C=C1)CN2C=C(C3=C2C=CC(=C3)C4=CC=C(C=C4)OC(F)(F)F)C(=O)C(=O)O | ||
Oplosbaarheid
|
In vitro |
DMSO
: 88 mg/mL
(200.28 mM)
Ethanol : 7 mg/mL Water : Insoluble |
Molariteitscalculator
|
In vivo |
|||||
In vivo Formuleringscalculator (Heldere oplossing)
Stap 1: Voer de onderstaande informatie in (Aanbevolen: Een extra dier voor het geval van verlies tijdens het experiment)
Stap 2: Voer de in vivo formulering in (Dit is alleen de calculator, geen formulering. Neem eerst contact met ons op als er geen in vivo formulering is in het gedeelte Oplosbaarheid.)
Berekeningsresultaten:
Werkconcentratie: mg/ml;
Methode voor het bereiden van DMSO-mastervloeistof: mg geneesmiddel vooraf opgelost in μL DMSO ( Concentratie mastervloeistof mg/mL, Neem eerst contact met ons op als de concentratie de DMSO-oplosbaarheid van de partij geneesmiddel overschrijdt. )
Methode voor het bereiden van in vivo formulering: Neem μL DMSO mastervloeistof, voeg vervolgens toeμL PEG300, mengen en helder maken, voeg vervolgens toeμL Tween 80, mengen en helder maken, voeg vervolgens toe μL ddH2O, mengen en helder maken.
Methode voor het bereiden van in vivo formulering: Neem μL DMSO mastervloeistof, voeg vervolgens toe μL Maïsolie, mengen en helder maken.
Opmerking: 1. Zorg ervoor dat de vloeistof helder is voordat u het volgende oplosmiddel toevoegt.
2. Zorg ervoor dat u het/de oplosmiddel(en) in de juiste volgorde toevoegt. U moet ervoor zorgen dat de verkregen oplossing, bij de vorige toevoeging, een heldere oplossing is voordat u verdergaat met het toevoegen van het volgende oplosmiddel. Fysische methoden zoals vortexen, echografie of een warmwaterbad kunnen worden gebruikt om het oplossen te bevorderen.
Werkingsmechanisme
| Targets/IC50/Ki |
PAI-1
2.7 μM
|
|---|---|
| In vitro |
Tiplaxtinin (PAI-039) vermindert celproliferatie, celadhesie en kolonieformatie, en induceert apoptose en anoikis in een panel van menselijke blaascellijnen.
|
| Kinase Assay |
Directe PAI-I in vitro activiteitsassays
|
|
De chromogene test wordt gestart door de toevoeging van Tiplaxtinin (PAI-039) (10 – 100 μM eindconcentratie, maximale DMSO-concentratie van 0,2%) aan recombinant humaan PAI-1 (140 nM in pH 6,6 buffer). Na een incubatie van 15 minuten bij 25°C wordt 70 nM recombinant humaan t-PA toegevoegd, en de combinatie van deze verbinding, PAI-1 en tPA wordt gedurende nog eens 30 minuten geïncubeerd. Na de tweede incubatie wordt Spectrozyme tPA toegevoegd en de extinctie gemeten bij 405 nm op 0 en 60 minuten. De relatieve PAI-1 remmende activiteit is gelijk aan de residuele tPA-activiteit in de tiplaxtinin / PAI-1 behandeling. Controlebehandelingen omvatten de volledige remming van tPA door PAI-1 bij de gebruikte molaire verhouding (2:1), en de afwezigheid van enig effect ervan op t-PA alleen. De immunofunctionele test is gebaseerd op de niet-SDS dissocieerbare interactie tussen tPA en actief PAI-1. Testplaten worden bekleed met 100 μl van een oplossing van t-PA (10 μg/ml in TBS), en overnacht bij 4 °C bewaard. Deze verbinding wordt opgelost in DMSO en verdund tot een eindconcentratie van 1-100 μM zoals hierboven beschreven. Vervolgens wordt het gedurende 15 minuten geïncubeerd met humaan PAI-1 (50 ng/ml), en een aliquot van deze oplossing wordt gedurende 1 uur toegevoegd aan de met t-PA beklede plaat. De oplossing wordt geaspireerd van de plaat, die vervolgens wordt gewassen met een buffer bestaande uit 0,05% Tween 20 en 0,1% BSA in TBS. Deze test detecteert alleen actief remmend PAI-1 (niet latent of substraat) gebonden aan de plaat, en wordt gekwantificeerd met behulp van een monoklonaal antilichaam tegen humaan PAI-1 (MA33B8). Een 1000X verdunning van MA33B8 wordt toegevoegd aan de plaat en gedurende één uur geïncubeerd, geaspireerd en gewassen. Een secundair antilichaam bestaande uit geiten-anti-muis IgG (H+L)-AP alkalische fosfatase conjugaat wordt toegevoegd, gedurende één uur geïncubeerd, geaspireerd en gewassen. Een 100 μl aliquot van alkalische fosfatase oplossing wordt toegevoegd, gevolgd door bepaling van de extinctie bij 405 nm 60 minuten later. De kwantificatie van residueel actief PAI-1 gebonden aan t-PA bij variërende concentraties ervan wordt gebruikt om de IC50 te bepalen door de resultaten te fitten aan een logistisch dosis-respons programma, waarbij de IC50 wordt gedefinieerd als de concentratie van de verbinding die nodig is om 50% remming van de PAI-1 activiteit te bereiken. De testgevoeligheid is 5 ng/ml humaan PAI-1 zoals bepaald uit een standaardcurve variërend van 0-100 ng/ml humaan PAI-1.
|
|
| In vivo |
Tiplaxtinin (PAI-039) heeft in meerdere studies verschillende biologische effecten laten zien. In een rattenmodel voor carotisthrombose verhoogt het (1 mg/kg, p.o.) de tijd tot occlusie en voorkomt het de vermindering van de carotisbloedstroom. In C57BL/6J muizen (1 mg/g voer) vermindert het Ang II-geïnduceerde aortaremodellering. Bij onbehandelde type 1 diabetische muizen herstelt deze verbinding (p.o.) de regeneratie van skeletspieren. In athymische muizen met humane kankercellijn T24 en HeLa xenografts, vermindert het (1 mg/kg, p.o.) de groei van tumortransplantaten, geassocieerd met een vermindering van tumorangiogenese, een vermindering van cellulaire proliferatie, en een toename van apoptose.
|
Referenties |
|
Technische ondersteuning
Tel: +1-832-582-8158 Ext:3
Als u nog andere vragen heeft, kunt u een bericht achterlaten.
