réservé à la recherche
Azilsartan Angiotensin Receptor antagoniste
N° Cat.S3046
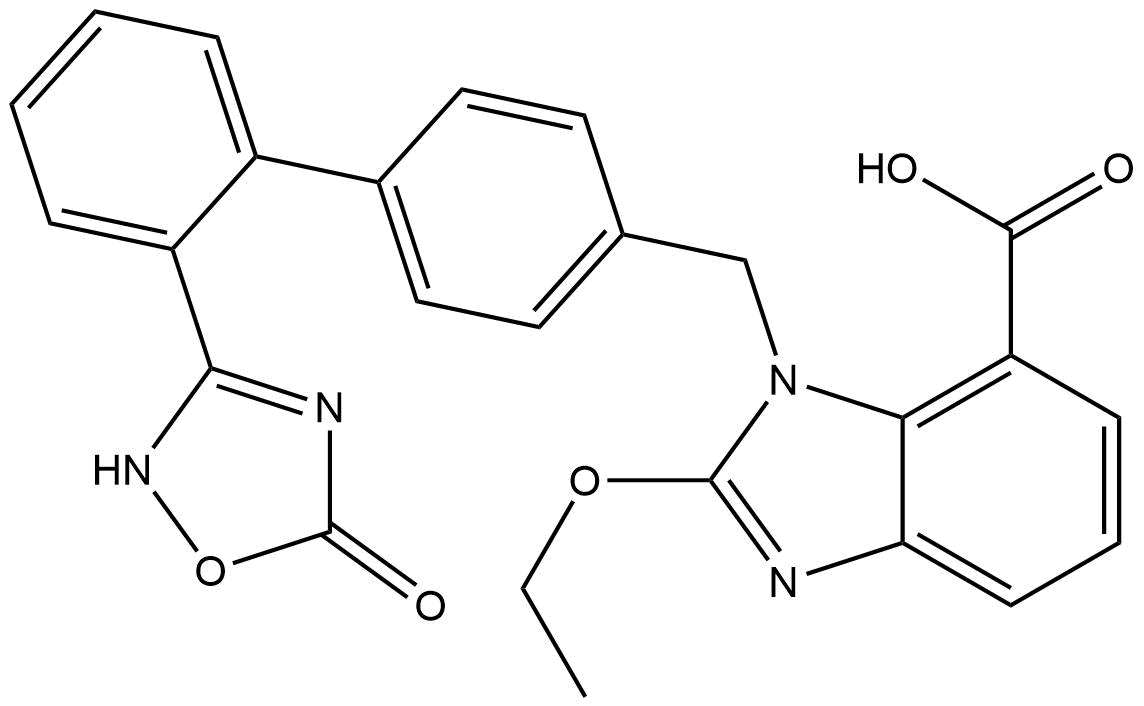
Structure chimique
Poids moléculaire: 456.45
Contrôle qualité
- Cité dans Nature Medicine pour sa qualité supérieure
- COA
- NMR
- HPLC
- SDS
- Fiche technique
| Cibles apparentées | CXCR Hedgehog/Smoothened PKA Adrenergic Receptor AChR 5-HT Receptor Histamine Receptor Dopamine Receptor Ras KRas |
|---|---|
| Autre Angiotensin Receptor Inhibiteurs | PD123319 ML221 A-779 Fimasartan Olodanrigan (EMA401) Buloxibutid AVE 0991 |
Informations chimiques, stockage et stabilité
| Poids moléculaire | 456.45 | Formule | C25H20N4O5 |
Stockage (À partir de la date de réception) | |
|---|---|---|---|---|---|
| N° CAS | 147403-03-0 | Télécharger le SDF | Stockage des solutions mères |
|
|
| Synonymes | TAK-536 | Smiles | CCOC1=NC2=CC=CC(=C2N1CC3=CC=C(C=C3)C4=CC=CC=C4C5=NOC(=O)N5)C(=O)O | ||
Solubilité
|
In vitro |
DMSO
: 91 mg/mL
(199.36 mM)
Water : Insoluble Ethanol : Insoluble |
Calculateur de molarité
|
In vivo |
|||||
Calculateur de formulation in vivo (Solution claire)
Étape 1 : Entrez les informations ci-dessous (Recommandé : Un animal supplémentaire pour tenir compte des pertes pendant lexpérience)
Étape 2 : Entrez la formulation in vivo (Ceci nest que le calculateur, pas la formulation. Veuillez nous contacter dabord sil ny a pas de formulation in vivo dans la section Solubilité.)
Résultats du calcul :
Concentration de travail : mg/ml;
Méthode de préparation du liquide maître DMSO : mg médicament prédissous dans μL DMSO ( Concentration du liquide maître mg/mL, Veuillez nous contacter dabord si la concentration dépasse la solubilité du DMSO du lot de médicament. )
Méthode de préparation de la formulation in vivo : Prendre μL DMSO liquide maître, ajouter ensuiteμL PEG300, mélanger et clarifier, ajouter ensuiteμL Tween 80, mélanger et clarifier, ajouter ensuite μL ddH2O, mélanger et clarifier.
Méthode de préparation de la formulation in vivo : Prendre μL DMSO liquide maître, ajouter ensuite μL Huile de maïs, mélanger et clarifier.
Remarque : 1. Assurez-vous que le liquide est clair avant dajouter le solvant suivant.
2. Assurez-vous dajouter le(s) solvant(s) dans lordre. Vous devez vous assurer que la solution obtenue lors de lajout précédent est une solution claire avant de procéder à lajout du solvant suivant. Des méthodes physiques telles que le vortex, les ultrasons ou le bain-marie peuvent être utilisées pour faciliter la dissolution.
Mécanisme daction
| Fonctionnalités |
A potent, orally active and specific AII receptor antagonist.
|
|---|---|
| Targets/IC50/Ki |
AT1 receptor
2.6 nM
|
| In vitro |
Azilsartan inhibe la liaison spécifique de 125I-Sar1-Ile8-AII aux récepteurs humains de l'angiotensine de type 1. Ce composé inhibe également l'accumulation d'inositol 1-phosphate (IP1) induite par l'AII dans l'essai cellulaire avec une valeur d'IC50 de 9,2 nM. Dans des bandelettes aortiques de lapin isolées, il réduit la réponse contractile maximale à l'AII avec une valeur de pD'2 de 9,9. Les effets inhibiteurs de cette substance chimique sur les réponses contractiles induites par l'AII persistent après lavage des bandelettes. Il supprime l'augmentation du taux de glucose plasmatique lors du test de tolérance au glucose oral (OGTT) sans changement significatif de la concentration d'insuline et améliore la sensibilité à l'insuline. Dans le muscle squelettique, cet agent diminue l'expression du TNF-α à des doses de 0,001%. Dans le tissu adipeux, il réduit l'expression du TNF-α mais augmente l'expression de l'adiponectine, du PPARγ, du C/EBα et de l'aP2. Dans des préadipocytes 3T3-L1 cultivés, ce composé améliore l'adipogenèse et exerce des effets plus importants que le valsartan sur l'expression des gènes codant pour le récepteur-α activé par les proliférateurs de peroxysomes (PPARα), le PPARδ, la leptine, l'adipsine et l'adiponectine. Il inhibe également puissamment la prolifération des cellules vasculaires en l'absence d'angiotensine II exogène.
|
| Kinase Assay |
Études de liaison aux radioligands sur les récepteurs AT1 humains
|
|
Un essai de liaison par radioligand est réalisé en utilisant des microplaques revêtues de récepteurs AT1 humains contenant 4,4 à 6,2 fmol de récepteurs/puits (10 μg de protéines membranaires/puits). Les puits revêtus de membrane sont incubés avec 45 μL de tampon d'essai (50 mM Tris-HCl, 5 mM MgCl2, 1 mM EDTA et 0,005% CHAPS, pH 7,4) contenant diverses concentrations d'Azilsartan à température ambiante. Après 90 minutes, 5 μL de 125I-Sar1-Ile8-AII (concentration finale 0,6 nM) dissous dans le tampon d'essai sont ajoutés aux puits, et la plaque est incubée pendant 5 heures. À chaque étape, la plaque est brièvement et doucement agitée sur un agitateur de plaque. Dans les expériences de lavage, les membranes sont incubées avec ce composé pendant 90 minutes, puis immédiatement lavées deux fois avec 200 μL/puits de tampon d'essai pour éliminer les composés non liés, et incubées pendant 5 heures supplémentaires avec 125I-Sar1-Ile8-AII. La radioactivité liée à la membrane est comptée à l'aide d'un compteur de scintillation et de luminescence TopCount Microplate. Dans les expériences visant à estimer le taux de dissociation de cette substance chimique des récepteurs AT1, les membranes sont incubées pendant 90 minutes avec ce composé à une concentration de 30 nM pour ce composé. Ce composé inhibe la liaison spécifique de 125I-Sar1-Ile8-AII à l'AT1 humain d'environ 90%. Les membranes sont ensuite immédiatement lavées deux fois avec 200 μL/puits de tampon d'essai et incubées pendant 240 minutes supplémentaires avec 125I-Sar1-Ile8-AII. La radioactivité liée à la membrane est comptée à l'aide du compteur de scintillation et de luminescence TopCount Microplate à 30 minutes, 60 minutes, 90 minutes, 120 minutes, 150 minutes, 180 minutes ou 240 minutes. La liaison non spécifique de 125I-Sar1-Ile8-AII est estimée en présence de 10 μM d'AII non marqué. L'AII non marqué est ajouté à nouveau après lavage pour l'expérience de lavage. La liaison spécifique est définie comme la liaison totale moins la liaison non spécifique.
|
|
| In vivo |
Chez les rats Koletsky, le traitement par Azilsartan abaisse la pression artérielle, la concentration plasmatique basale d'insuline et l'indice d'évaluation du modèle d'homéostasie de la résistance à l'insuline, et inhibe l'augmentation excessive des concentrations plasmatiques de glucose et d'insuline pendant le test de tolérance au glucose oral. Ce composé régule négativement l'expression de la 11β-hydroxystéroïde déshydrogénase de type 1.
|
Références |
|
Informations sur lessai clinique
(données de https://clinicaltrials.gov, mis à jour le 2024-05-22)
| Numéro NCT | Recrutement | Conditions | Sponsor/Collaborateurs | Date de début | Phases |
|---|---|---|---|---|---|
| NCT04668157 | Completed | Hypertension |
Takeda |
May 17 2021 | Phase 3 |
| NCT03434977 | Completed | Healthy Volunteers |
Takeda |
February 14 2018 | Phase 1 |
| NCT03042299 | Completed | Japanese Healthy Adult Male Participants |
Takeda |
February 10 2017 | Phase 1 |
| NCT02791438 | Completed | Pediatric Hypertension |
Takeda |
August 18 2016 | Phase 3 |
| NCT02541669 | Completed | Healthy Volunteer |
Takeda |
November 20 2015 | Phase 1 |
| NCT02451150 | Completed | Pediatric Hypertension |
Takeda |
August 2015 | Phase 3 |
Support technique
Tel: +1-832-582-8158 Ext:3
Si vous avez dautres questions, veuillez laisser un message.
