réservé à la recherche
Clemastine (HS-592) Fumarate Antagoniste du récepteur H1
N° Cat.S1847
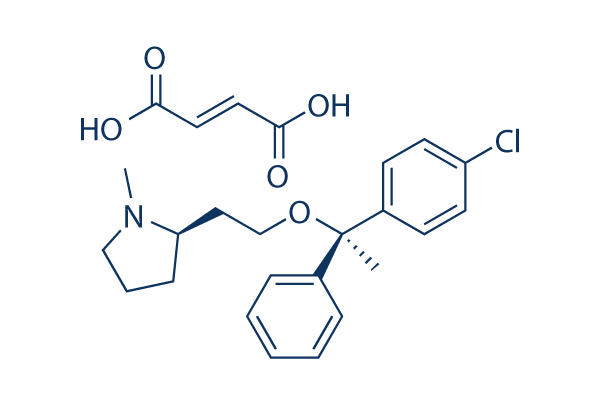
Structure chimique
Poids moléculaire: 459.96
Contrôle qualité
| Cibles apparentées | Adrenergic Receptor AChR 5-HT Receptor COX Calcium Channel Dopamine Receptor GABA Receptor TRP Channel Cholinesterase (ChE) GluR |
|---|---|
| Autre Histamine Receptor Inhibiteurs | GSK2879552 Dihydrochloride JNJ-7777120 Ebastine Ciproxifan Maleate Mianserin HCl Astemizole Lafutidine Mizolastine Rupatadine Fumarate Betahistine 2HCl |
Informations chimiques, stockage et stabilité
| Poids moléculaire | 459.96 | Formule | C21H26ClNO.C4H4O4 |
Stockage (À partir de la date de réception) | |
|---|---|---|---|---|---|
| N° CAS | 14976-57-9 | Télécharger le SDF | Stockage des solutions mères |
|
|
| Synonymes | HS-592 fumarate, Meclastine fumarate | Smiles | CC(C1=CC=CC=C1)(C2=CC=C(C=C2)Cl)OCCC3CCCN3C.C(=CC(=O)O)C(=O)O | ||
Solubilité
|
In vitro |
DMSO
: 11 mg/mL
(23.91 mM)
Water : Insoluble Ethanol : Insoluble |
Calculateur de molarité
|
In vivo |
|||||
Calculateur de formulation in vivo (Solution claire)
Étape 1 : Entrez les informations ci-dessous (Recommandé : Un animal supplémentaire pour tenir compte des pertes pendant lexpérience)
Étape 2 : Entrez la formulation in vivo (Ceci nest que le calculateur, pas la formulation. Veuillez nous contacter dabord sil ny a pas de formulation in vivo dans la section Solubilité.)
Résultats du calcul :
Concentration de travail : mg/ml;
Méthode de préparation du liquide maître DMSO : mg médicament prédissous dans μL DMSO ( Concentration du liquide maître mg/mL, Veuillez nous contacter dabord si la concentration dépasse la solubilité du DMSO du lot de médicament. )
Méthode de préparation de la formulation in vivo : Prendre μL DMSO liquide maître, ajouter ensuiteμL PEG300, mélanger et clarifier, ajouter ensuiteμL Tween 80, mélanger et clarifier, ajouter ensuite μL ddH2O, mélanger et clarifier.
Méthode de préparation de la formulation in vivo : Prendre μL DMSO liquide maître, ajouter ensuite μL Huile de maïs, mélanger et clarifier.
Remarque : 1. Assurez-vous que le liquide est clair avant dajouter le solvant suivant.
2. Assurez-vous dajouter le(s) solvant(s) dans lordre. Vous devez vous assurer que la solution obtenue lors de lajout précédent est une solution claire avant de procéder à lajout du solvant suivant. Des méthodes physiques telles que le vortex, les ultrasons ou le bain-marie peuvent être utilisées pour faciliter la dissolution.
Mécanisme daction
| Targets/IC50/Ki |
mTOR
Histamine H1 receptor
3 nM
|
|---|---|
| In vitro |
Le fumarate de Clemastine inhibe l'augmentation de [Ca2+]i induite par l'histamine dans les cellules HL-60 avec une IC50 de 3 nM, comparé à la chlorphéniramine ou la diphenhydramine avec des valeurs d'IC50 de 20 nM et 100 nM, respectivement. À des concentrations ≥25 μM, le fumarate de Clemastine bloque significativement les réactions NK et ADCC des lymphocytes contre la lignée cellulaire d'érythroleucémie humaine K562 et la lignée cellulaire de lymphoblastes B humains SB, respectivement. Le fumarate de Clemastine inhibe la contraction de l'iléon de cobaye induite par l'histamine avec une IC50 de 231 nM. Le fumarate de Clemastine inhibe puissamment le canal HERG K+ de manière concentration-dépendante dans les cellules HEK 293 exprimant stablement les canaux HERG avec une IC50 de 12 nM, ce qui peut être atténué par la mutation Y652A ou F656A de HERG. Le fumarate de Clemastine potentialise significativement l'augmentation de [Ca2+]i induite par l'ATP dans les cellules HEKhP2X7, ne dépendant pas du blocage du Histamine Receptor mais de la sensibilisation du récepteur P2X7 de manière concentration-dépendante avec une EC50 de 10 μM, et augmente la libération d'IL-1β par les macrophages humains induits par le LPS. |
| Kinase Assay |
Inhibition de [Ca2+]i
|
|
Les cellules HL-60 sont suspendues à 1×107 cellules/mL dans un tampon composé de 138 mM NaCl, 6 mM KC1, 1 mM MgSO4, 1 mM Na2HPO4, 5 mM NaHCO3, 5,5 mM glucose, et 20 mM HEPES-NaOH, pH 7,4, complété par 0,1% (p/v) d'albumine sérique bovine. Le colorant fura-2/AM est ajouté à une concentration de 4 μM, et les cellules sont incubées pendant 10 minutes à 37 °C. Ensuite, les cellules sont diluées avec le tampon susmentionné à une concentration de 5×106 cellules/mL et incubées pendant 45 minutes à 37 °C. Par la suite, les cellules sont diluées avec le tampon susmentionné à une concentration finale de 0,5 × 106 cellules/mL et centrifugées à 250 g pendant 10 minutes à 20 °C. Les cellules sont suspendues à 1,0 × 106 cellules/mL dans le tampon susmentionné et conservées à 20 °C jusqu'à la mesure. Les cellules HL-60 sont utilisées jusqu'à 4 heures après le chargement avec fura-2/AM, et suspendues dans 2 mL du tampon susmentionné, en utilisant des cuvettes de fluorescence en acrylique. Les cellules HL-60 sont incubées pendant 3 minutes à 37 °C, en présence de 1 mM Ca2+ et de diverses concentrations de fumarate de Clemastine, avant l'ajout d'histamine (100 μM). La fluorescence est déterminée à 37 °C, avec une agitation constante des cellules à 1×103 tr/min, à l'aide d'un spectrofluoromètre Ratio II. La fluorescence basale ([Ca2+]i basale) est mesurée pendant 1 minute. Les valeurs de [Ca2+]i basales sont soustraites des valeurs de [Ca2+]i maximales correspondantes, pour calculer l'augmentation de [Ca2+]i. Les longueurs d'onde d'excitation et d'émission sont respectivement de 340 et 500 nm. La valeur IC50 est évaluée à partir de la courbe compétitive.
|
|
| In vivo |
L'administration de fumarate de Clemastine (5-20 mg/kg) présente un effet inhibiteur significatif sur l'œdème de la patte au zymosan et l'œdème de l'oreille à l'huile de croton induits simultanément chez les rats de manière dose-dépendante, avec une inhibition de 53,6% et 46,8% respectivement à la dose de 20 mg/kg, et avec des valeurs ID50 de 18,0 mg/kg et 20,5 mg/kg respectivement. Le traitement au fumarate de Clemastine réduit fortement les réponses immunitaires innées à Listeria monocytogenes chez la souris en interférant avec la production de cytokines pro-inflammatoires telles que le TNF-α et l'IL-6 médiée par la kinase régulée par le signal extracellulaire (ERK), étonnamment non dépendante du blocage du Histamine Receptor, conduisant à une mortalité significativement plus élevée. |
Références |
|
Informations sur lessai clinique
(données de https://clinicaltrials.gov, mis à jour le 2024-05-22)
| Numéro NCT | Recrutement | Conditions | Sponsor/Collaborateurs | Date de début | Phases |
|---|---|---|---|---|---|
| NCT06065670 | Not yet recruiting | Demyelinating Diseases|Demyelination; Corpus Callosum|Multiple Sclerosis Brain Lesion|Multiple Sclerosis Acute and Progressive|Clinically Isolated Syndrome CNS Demyelinating |
University of California San Francisco |
March 1 2024 | Phase 1|Phase 2 |
| NCT05359653 | Recruiting | Multiple Sclerosis (MS)|Multiple Sclerosis Relapsing-Remitting|Multiple Sclerosis Primary Progressive|Multiple Sclerosis Chronic Progressive|Multiple Sclerosis Relapse|Multiple Sclerosis Brain Lesion|Multiple Sclerosis Benign |
University of California San Francisco|United States Department of Defense |
August 1 2023 | Phase 1|Phase 2 |
| NCT05131828 | Recruiting | Multiple Sclerosis |
Cambridge University Hospitals NHS Foundation Trust|University of Cambridge |
March 8 2022 | Phase 2 |
| NCT02040298 | Completed | Multiple Sclerosis Relapsing-Remitting |
University of California San Francisco |
January 2014 | Phase 2 |
| NCT01239719 | Unknown status | Allergy|Dermatitis |
Azidus Brasil |
March 2011 | Phase 3 |
Support technique
Tel: +1-832-582-8158 Ext:3
Si vous avez dautres questions, veuillez laisser un message.
