Datos técnicos
| Fórmula | C6H6N6O2 |
||||||
| Peso molecular | 194.15 | Número CAS | 85622-93-1 | ||||
| Solubilidad (25°C)* | In vitro | DMSO | 19 mg/mL (97.86 mM) | ||||
| Water | 3 mg/mL (15.45 mM) | ||||||
| Ethanol | Insoluble | ||||||
| In vivo (Agregue los solventes al producto individualmente y en orden.) |
|
||||||
|
* <1 mg/ml significa ligeramente soluble o insoluble. * Tenga en cuenta que Selleck prueba la solubilidad de todos los compuestos internamente, y la solubilidad real puede diferir ligeramente de los valores publicados. Esto es normal y se debe a ligeras variaciones entre lotes. * Envío a temperatura ambiente (Las pruebas de estabilidad demuestran que este producto se puede enviar sin medidas de refrigeración.) |
|||||||
Preparación de soluciones madre
Actividad biológica
| Descripción | La Temozolomida (TMZ) es un agente alquilante monofuncional SN-1 que puede modificar los átomos de nitrógeno en el anillo de ADN y el grupo oxígeno extracíclico, se convierte químicamente a MTIC y se degrada a catión metildiazonio, que transfiere grupos metilo al ADN a pH fisiológico. Es un inductor de daño en el ADN en células L-1210 y L-1210/BCNU. Este compuesto induce la apoptosis y exhibe actividad antitumoral. | |
|---|---|---|
| Objetivos |
|
|
| In vitro | La Temozolomida (TMZ) provoca la formación de sitios lábiles al álcali en el ADN que están presentes en cantidades similares y se reparan a una velocidad similar en las líneas celulares L-1210 y L-1210/BCNU. En L-1210, pero no en L-1210/BCNU, este compuesto induce un arresto de las células en las fases SL-G2-M. Su sensibilidad tanto de células quimiosensibles como resistentes (D54-R y U87-R) se mejora significativamente bajo hiperoxia. Tanto el compuesto como la hiperoxia se asocian con un aumento de la fosforilación de ERK p44/42 MAPK (Erk1/2), pero en menor medida en las células D54-R, lo que sugiere que la actividad de Erk1/2 puede estar implicada en la regulación de la hiperoxia y la muerte celular mediada por TMZ. La hiperoxia mejora su toxicidad en las células de GBM mediante la inducción de apoptosis, posiblemente a través de vías relacionadas con MAPK. Induce en los monocitos las vías de respuesta al daño del ADN ATM-Chk2 y ATR-Chk1, lo que resulta en la activación de p53. La exposición crónica a este compuesto resulta en la resistencia adquirida a TMZ y eleva la expresión de miR-21. El tratamiento con él desencadena el estrés del retículo endoplásmico (RE) con un aumento de la expresión de las proteínas GADD153 y GRP78, y disminuye la proteína pro-caspasa 12. Induce la Autophagy a través de mecanismos dependientes del daño mitocondrial y del estrés del RE para proteger las células de glioma. |
|
| In vivo | Después de una dosis diaria i.p. de 40 mg/kg durante 5 días consecutivos (días 1-5 después del trasplante tumoral), el TMZ (Temozolomide) aumenta la esperanza de vida en un 86% en L-1210 y en un 22% en L-1210/BCNU. En L-1210/BCNU no se observa ningún efecto después de un tratamiento de 100 μM o 200 μM; solo 400 μM de este compuesto produjeron una acumulación de células en fase premitótica, pero mucho menos que en L-1210. En L-1210/BCNU, la acumulación máxima de células en SL-G2-M es, después de 48 a 72 horas, aproximadamente del 30% en comparación con el 23% en células no tratadas. La acumulación de células en SL-G2-M también ocurrió cuando se trataron ratones con leucemia L-1210 i.v. con este compuesto (40 mg/kg). No se observa tal efecto en las células L-1210/BCNU de ratones a los que se les administró la misma dosis de fármaco. |
|
| Características | La metazolastona es un agente alquilante de segunda generación. |
Protocolo (de referencia)
| Ensayo celular: |
|
|---|---|
| Estudio en animales: |
|
Referencias
|
Validación de productos por parte del cliente
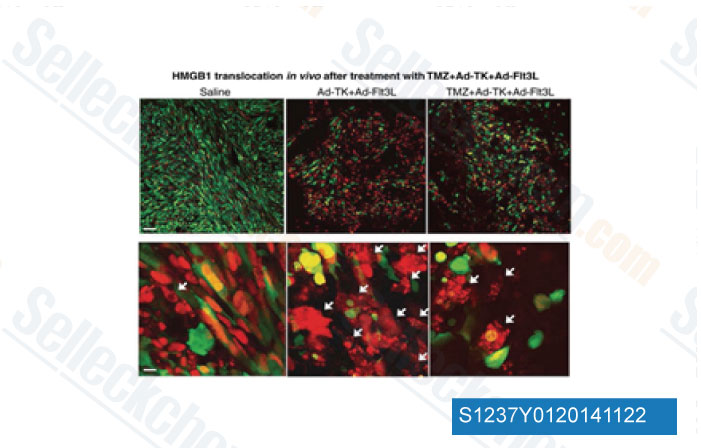
-
Datos de [ Clin Cancer Res , 2014 , 20(6), 1555-65 ]
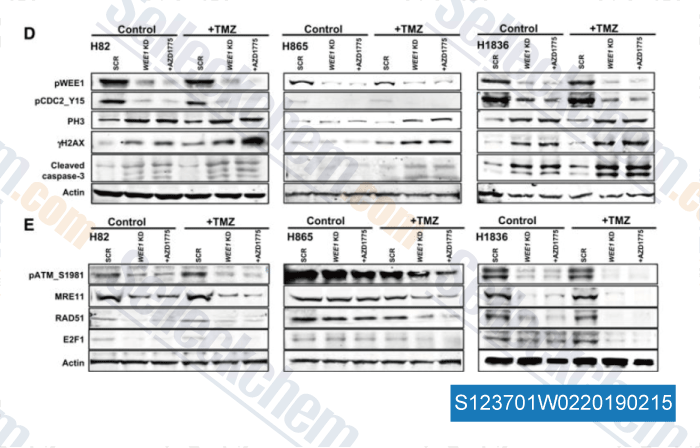
-
Datos de [ , , Clin Cancer Res, 2017, 23(20):6239-6253 ]
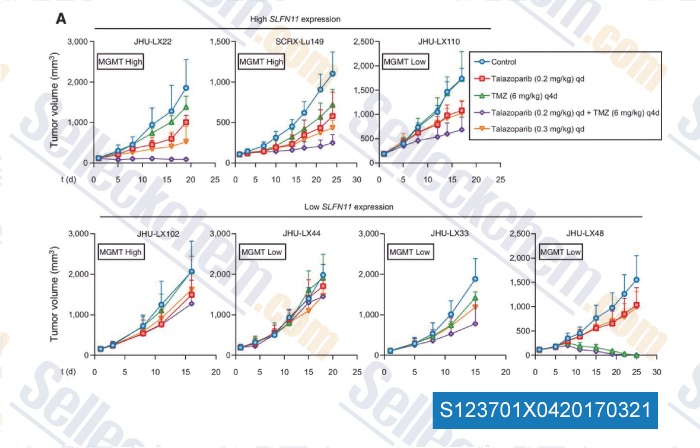
-
Datos de [ , , Clin Cancer Res, 2017, 23(2):523-535 ]
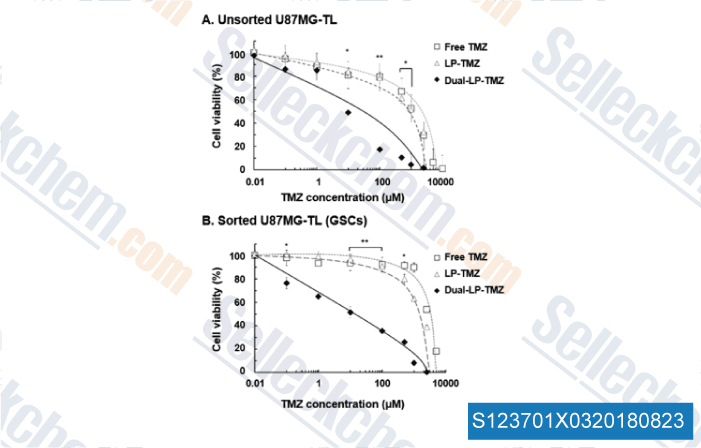
-
Datos de [ , , J Control Release, 2018, 269:245-257 ]
Sellecks TMZ(Temozolomide) Ha sido citado por 254 Publicaciones
| Proteogenomic characterization of non-functional pancreatic neuroendocrine tumors unravels clinically relevant subgroups [ Cancer Cell, 2025, 43(4):776-796.e14] | PubMed: 40185092 |
| Cisplatin and temozolomide combinatorial treatment triggers hypermutability and immune surveillance in experimental cancer models [ Cancer Cell, 2025, S1535-6108(25)00223-5] | PubMed: 40513578 |
| Multidimensional third-generation sequencing of modified DNA bases allows interrogation of complex biological systems [ Nat Commun, 2025, 16(1):5676] | PubMed: 40593667 |
| HR eye & MMR eye: one-day assessment of DNA repair-defective tumors eligible for targeted therapy [ Nat Commun, 2025, 16(1):4239] | PubMed: 40355434 |
| A cancer persistent DNA repair circuit driven by MDM2, MDM4 (MDMX), and mutant p53 for recruitment of MDC1 and 53BP1 on chromatin [ Nucleic Acids Res, 2025, 53(13)gkaf627] | PubMed: 40626562 |
| Calnexin promotes glioblastoma progression by inducing protective mitophagy through the MEK/ERK/BNIP3 pathway [ Theranostics, 2025, 15(6):2624-2648] | PubMed: 39990231 |
| Overexpression of miR-124 enhances the therapeutic benefit of TMZ treatment in the orthotopic GBM mice model by inhibition of DNA damage repair [ Cell Death Dis, 2025, 16(1):47] | PubMed: 39865088 |
| Transketolase attenuates the chemotherapy sensitivity of glioma cells by modulating R-loop formation [ Cell Rep, 2025, 44(1):115142] | PubMed: 39792560 |
| CDK12 regulates cellular metabolism to promote glioblastoma growth [ JCI Insight, 2025, 10(21)e190780] | PubMed: 40996961 |
| EZH2 inhibition sensitizes MYC-high medulloblastoma cancers to PARP inhibition by regulating NUPR1-mediated DNA repair [ Oncogene, 2025, 44(6):391-405] | PubMed: 39562655 |
POLÍTICA DE DEVOLUCIÓN
La Política de Devolución Incondicional de Selleck Chemical garantiza una experiencia de compra en línea fluida para nuestros clientes. Si no está satisfecho con su compra de alguna manera, puede devolver cualquier artículo(s) dentro de los 7 días posteriores a su recepción. En caso de problemas de calidad del producto, ya sean problemas relacionados con el protocolo o con el producto, puede devolver cualquier artículo(s) dentro de los 365 días a partir de la fecha de compra original. Siga las instrucciones a continuación al devolver productos.
ENVÍO Y ALMACENAMIENTO
Los productos Selleck se transportan a temperatura ambiente. Si recibe el producto a temperatura ambiente, tenga la seguridad de que el Departamento de Inspección de Calidad de Selleck ha realizado experimentos para verificar que la colocación a temperatura normal durante un mes no afectará la actividad biológica de los productos en polvo. Después de la recogida, guarde el producto de acuerdo con los requisitos descritos en la hoja de datos. La mayoría de los productos Selleck son estables en las condiciones recomendadas.
NO PARA USO HUMANO, DIAGNÓSTICO VETERINARIO O TERAPÉUTICO.
