Datos técnicos
| Fórmula | C22H27FN4O2 |
||||||
| Peso molecular | 398.47 | Número CAS | 557795-19-4 | ||||
| Solubilidad (25°C)* | In vitro | DMSO | 25 mg/mL (62.73 mM) | ||||
| Water | Insoluble | ||||||
| Ethanol | Insoluble | ||||||
| In vivo (Agregue los solventes al producto individualmente y en orden.) |
|
||||||
|
* <1 mg/ml significa ligeramente soluble o insoluble. * Tenga en cuenta que Selleck prueba la solubilidad de todos los compuestos internamente, y la solubilidad real puede diferir ligeramente de los valores publicados. Esto es normal y se debe a ligeras variaciones entre lotes. * Envío a temperatura ambiente (Las pruebas de estabilidad demuestran que este producto se puede enviar sin medidas de refrigeración.) |
|||||||
Preparación de soluciones madre
Actividad biológica
| Descripción | Sunitinib es un inhibidor de RTK multidirigido que actúa sobre VEGFR2 (Flk-1) y PDGFRβ con una IC50 de 80 nM y 2 nM, y también inhibe c-Kit. Sunitinib también es un inhibidor dosis-dependiente de la actividad de autofosforilación de IRE1α. Sunitinib induce autophagy y apoptosis. | ||||||||
|---|---|---|---|---|---|---|---|---|---|
| Objetivos |
|
||||||||
| In vitro | Sunitinib también inhibe potentemente Kit y FLT-3. Este compuesto es un potente inhibidor competitivo de ATP de VEGFR2 (Flk1) y PDGFRβ con Ki de 9 nM y 8 nM, respectivamente, mostrando una selectividad >10 veces mayor para VEGFR2 y PDGFR que para FGFR-1, EGFR, Cdk2, Met, IGFR-1, Abl y src. En células NIH-3T3 privadas de suero que expresan VEGFR2 o PDGFRβ, inhibe la fosforilación de VEGFR2 dependiente de VEGF y la fosforilación de PDGFRβ dependiente de PDGF con IC50 de 10 nM y 10 nM, respectivamente. Este químico inhibe la proliferación de HUVEC privadas de suero inducida por VEGF con una IC50 de 40 nM, e inhibe la proliferación de células NIH-3T3 que sobreexpresan PDGFRβ o PDGFRα inducida por PDGF con IC50 de 39 nM y 69 nM, respectivamente. Inhibe la fosforilación de FLT3 de tipo salvaje, FLT3-ITD y FLT3-Asp835 con IC50 de 250 nM, 50 nM y 30 nM, respectivamente. Este inhibidor inhibe la proliferación de células MV4;11 y OC1-AML5 con IC50 de 8 nM y 14 nM, respectivamente, e induce apoptosis de manera dosis-dependiente. | ||||||||
| In vivo | Consistente con la inhibición sustancial y selectiva de la fosforilación y señalización de VEGFR2 o PDGFR in vivo, Sunitinib (20-80 mg/kg/día) exhibe una actividad antitumoral amplia y potente, dosis-dependiente, contra una variedad de modelos de xenoinjertos tumorales, incluyendo HT-29, A431, Colo205, H-460, SF763T, C6, A375 o MDA-MB-435. La dosificación de este compuesto a 80 mg/kg/día durante 21 días conduce a una regresión tumoral completa en seis de ocho ratones, sin que el tumor vuelva a crecer durante un período de observación de 110 días después del final del tratamiento. Una segunda ronda de tratamiento con este compuesto sigue siendo eficaz contra tumores que no regresaron completamente durante la primera ronda de tratamiento. El tratamiento con este compuesto resulta en una disminución significativa de la MVD tumoral, con una reducción de ~40% en los tumores de glioma SF763T. El tratamiento con SU11248 resulta en una inhibición completa del crecimiento tumoral adicional de los xenoinjertos de PC-3M que expresan luciferasa, a pesar de no haber reducción en el tamaño del tumor. El tratamiento con este compuesto (20 mg/kg/día) suprime drásticamente el crecimiento de xenoinjertos subcutáneos MV4;11 (FLT3-ITD) y prolonga la supervivencia en el modelo de injerto de médula ósea FLT3-ITD. |
Protocolo (de referencia)
| Ensayo de quinasa: |
|
|---|---|
| Ensayo celular: |
|
| Estudio en animales: |
|
Referencias
|
Validación de productos por parte del cliente
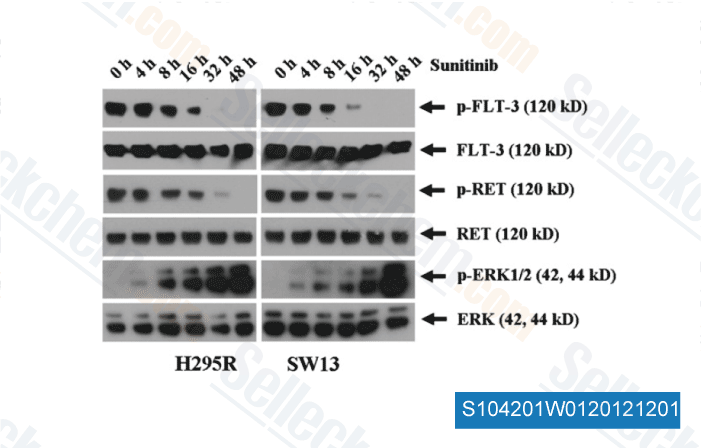
-
Datos de [ Surgery , 2012 , 152, 1045-50 ]
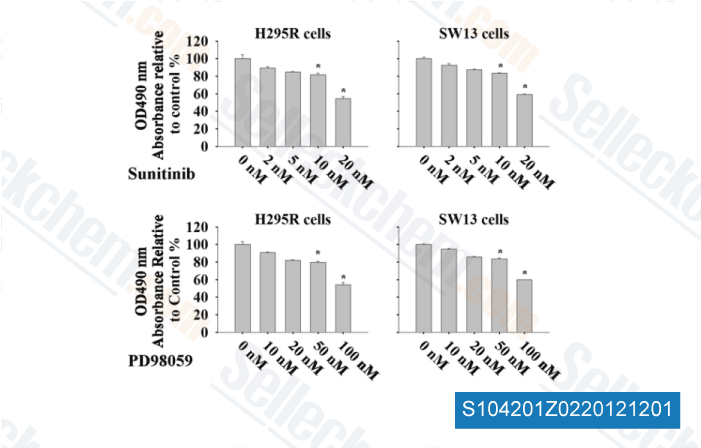
-
Datos de [ Surgery , 2012 , 152, 1045-50 ]
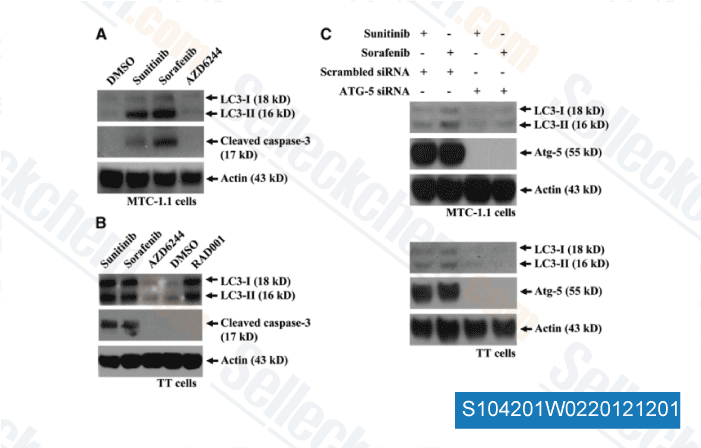
-
Datos de [ Surgery , 2012 , 152, 1142-9 ]
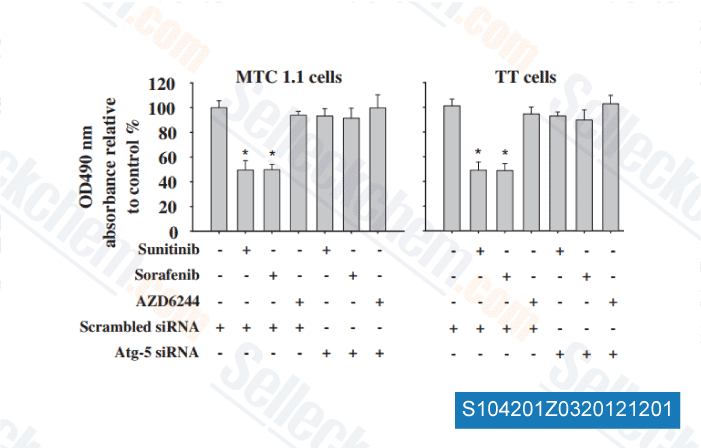
-
Datos de [ Surgery , 2012 , 152, 1142-9 ]
Sellecks Sunitinib (SU-11248) Ha sido citado por 257 Publicaciones
| Proteogenomic characterization of non-functional pancreatic neuroendocrine tumors unravels clinically relevant subgroups [ Cancer Cell, 2025, 43(4):776-796.e14] | PubMed: 40185092 |
| Single-cell multi-omics reveals that FABP1 + renal cell carcinoma drive tumor angiogenesis through the PLG-PLAT axis under fatty acid reprogramming [ Mol Cancer, 2025, 24(1):179] | PubMed: 40518526 |
| Multi-layer stratified oncology platform utilizing transcriptomics, prostate cancer organoids, and modeling of drug response [ J Exp Clin Cancer Res, 2025, 44(1):290] | PubMed: 41094672 |
| O-GlcNAcylation of UBAP2L regulates stress granule formation and sunitinib resistance in clear cell renal cell carcinoma [ J Exp Clin Cancer Res, 2025, 44(1):273] | PubMed: 41029457 |
| The novel hydrogen-PT2385-silncARSR nanocomplex impairs tumor angiogenesis and mitochondrial activity in sunitinib-resistant renal cancer [ Mater Today Bio, 2025, 35:102450] | PubMed: 41235366 |
| Unveiling the Anti-Angiogenic Potential of Small-Molecule (Kinase) Inhibitors for Application in Rheumatoid Arthritis [ Cells, 2025, 14(2)102] | PubMed: 39851530 |
| Baicalin reduces sunitinib-induced cardiotoxicity in renal carcinoma PDX model by inhibiting myocardial injury, apoptosis and fibrosis [ Front Pharmacol, 2025, 16:1563194] | PubMed: 40264678 |
| Kinomic profiling to predict sunitinib response of patients with metastasized clear cell Renal Cell Carcinoma [ Neoplasia, 2025, 60:101108] | PubMed: 39724752 |
| CYP1B1 promotes angiogenesis and sunitinib resistance in clear cell renal cell carcinoma via USP5-mediated HIF2α deubiquitination [ Neoplasia, 2025, 66:101186] | PubMed: 40435846 |
| Hyperpolarized [1-13C]pyruvate NMR spectroscopy reveals transition of tumor energy metabolism in microscale multicellular spheroids [ Sci Rep, 2025, 15(1):19303] | PubMed: 40456829 |
POLÍTICA DE DEVOLUCIÓN
La Política de Devolución Incondicional de Selleck Chemical garantiza una experiencia de compra en línea fluida para nuestros clientes. Si no está satisfecho con su compra de alguna manera, puede devolver cualquier artículo(s) dentro de los 7 días posteriores a su recepción. En caso de problemas de calidad del producto, ya sean problemas relacionados con el protocolo o con el producto, puede devolver cualquier artículo(s) dentro de los 365 días a partir de la fecha de compra original. Siga las instrucciones a continuación al devolver productos.
ENVÍO Y ALMACENAMIENTO
Los productos Selleck se transportan a temperatura ambiente. Si recibe el producto a temperatura ambiente, tenga la seguridad de que el Departamento de Inspección de Calidad de Selleck ha realizado experimentos para verificar que la colocación a temperatura normal durante un mes no afectará la actividad biológica de los productos en polvo. Después de la recogida, guarde el producto de acuerdo con los requisitos descritos en la hoja de datos. La mayoría de los productos Selleck son estables en las condiciones recomendadas.
NO PARA USO HUMANO, DIAGNÓSTICO VETERINARIO O TERAPÉUTICO.
