Datos técnicos
| Fórmula | C21H16ClF3N4O3 |
||||||||||||||||||
| Peso molecular | 464.82 | Número CAS | 284461-73-0 | ||||||||||||||||
| Solubilidad (25°C)* | In vitro | DMSO | 120 mg/mL (258.16 mM) | ||||||||||||||||
| Water | Insoluble | ||||||||||||||||||
| Ethanol | Insoluble | ||||||||||||||||||
| In vivo (Agregue los solventes al producto individualmente y en orden.) |
|
||||||||||||||||||
|
* <1 mg/ml significa ligeramente soluble o insoluble. * Tenga en cuenta que Selleck prueba la solubilidad de todos los compuestos internamente, y la solubilidad real puede diferir ligeramente de los valores publicados. Esto es normal y se debe a ligeras variaciones entre lotes. * Envío a temperatura ambiente (Las pruebas de estabilidad demuestran que este producto se puede enviar sin medidas de refrigeración.) |
|||||||||||||||||||
Preparación de soluciones madre
Actividad biológica
| Descripción | Sorafenib es un inhibidor multiquinasa de Raf-1 y B-Raf con una IC50 de 6 nM y 22 nM en ensayos libres de células, respectivamente. Sorafenib inhibe VEGFR-2, VEGFR-3, PDGFR-β, Flt-3 y c-KIT con una IC50 de 90 nM, 20 nM, 57 nM, 59 nM y 68 nM, respectivamente. Sorafenib induce autophagy y apoptosis y activa ferroptosis con actividad antitumoral. | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Objetivos |
|
|||||||||||
| In vitro | Sorafenib inhibe la actividad de B-Raf tanto de tipo salvaje como mutante V599E con una IC50 de 22 nM y 38 nM, respectivamente. Este compuesto también inhibe potentemente mVEGFR2 (Flk-1), mVEGFR3, mPDGFRβ, Flt3 y c-Kit con una IC50 de 15 nM, 20 nM, 57 nM, 58 nM y 68 nM, respectivamente. Inhibe débilmente FGFR-1 con una IC50 de 580 nM. Este químico no es activo contra ERK-1, MEK-1, EGFR, HER-2, IGFR-1, c-Met, PKB, PKA, cdk1/cyclinB, PKCα, PKCγ y pim-1. Inhibe notablemente la fosforilación de VEGFR2 en células NIH 3T3 con una IC50 de 30 nM, y la fosforilación de Flt-3 en células HEK-293 con una IC50 de 20 nM. Este agente bloquea potentemente la fosforilación de MEK 1/2 y ERK 1/2 en la mayoría de las líneas celulares, pero no en las células A549 o H460, sin tener ningún efecto sobre la inhibición de la vía PKB. Inhibe la proliferación de células HAoSMC y MDA-MB-231 con una IC50 de 0,28 μM y 2,6 μM, respectivamente. Además de la inhibición de la vía de señalización RAF/MEK/ERK, este compuesto inhibe significativamente la fosforilación de eIF4E y regula a la baja los niveles de Mcl-1 en células de carcinoma hepatocelular (HCC) de una manera independiente de MEK/ERK. Inhibe la proliferación de células PLC/PRF/5 y HepG2 con una IC50 de 6,3 μM y 4,5 μM, respectivamente, y conduce a la inducción significativa de apoptosis. | |||||||||||
| In vivo | La administración oral de Sorafenib (~60 mg/kg) demuestra una actividad antitumoral de amplio espectro, dosis-dependiente, contra una variedad de modelos de xenoinjertos tumorales humanos, incluyendo MDA-MB-231, Colo-205, HT-29, DLD-1, NCI-H460 y A549, sin evidencia de toxicidad. En asociación con la eficacia antitumoral, este tratamiento con compuestos inhibe potentemente la fosforilación de MEK 1/2 y los niveles de pERK 1/2 en xenoinjertos HT-29 y MDA-MB-231, pero no en xenoinjertos Colo-205, y suprime significativamente el área microvascular (MVA) y la densidad microvascular (MVD) en xenoinjertos tumorales MDA MB-231, HT-29 y Colo-205. Este agente produce una inhibición del crecimiento dosis-dependiente de los xenoinjertos tumorales PLC/PRF/5 en ratones SCID con TGIs del 49% y 78% a 10 mg/kg y 30 mg/kg, respectivamente, lo que es consistente con la inhibición de la fosforilación de ERK y eIF4E, la reducción del área microvascular y la inducción de apoptosis de las células tumorales. Sensibiliza las células bax-/- a TRAIL de manera dosis-dependiente, a través de un mecanismo que involucra la regulación a la baja de la expresión de Mcl-1 y cIAP2 mediada por NF-κB. La combinación de este compuesto (30-60 mg/kg) con TRAIL (5 mg/kg) muestra una eficacia dramática en xenoinjertos tumorales HCT116 bax-/- y HT29 resistentes a TRAIL. |
Protocolo (de referencia)
| Ensayo de quinasa: |
|
|---|---|
| Ensayo celular: |
|
| Estudio en animales: |
|
Referencias
|
Validación de productos por parte del cliente
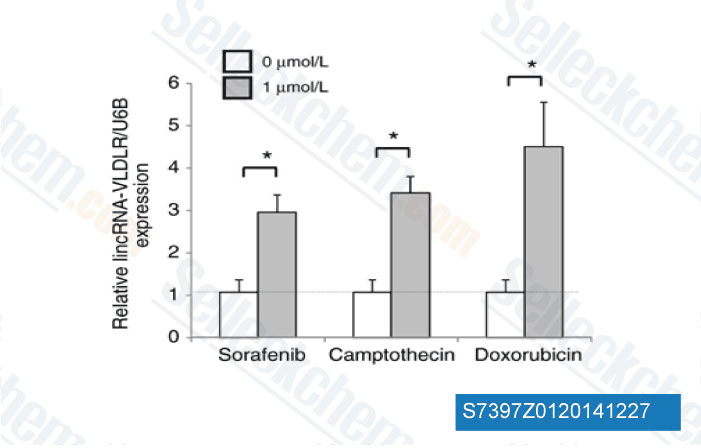
-
Datos de [ Mol Cancer Res , 2014 , 12(10), 1377-87 ]
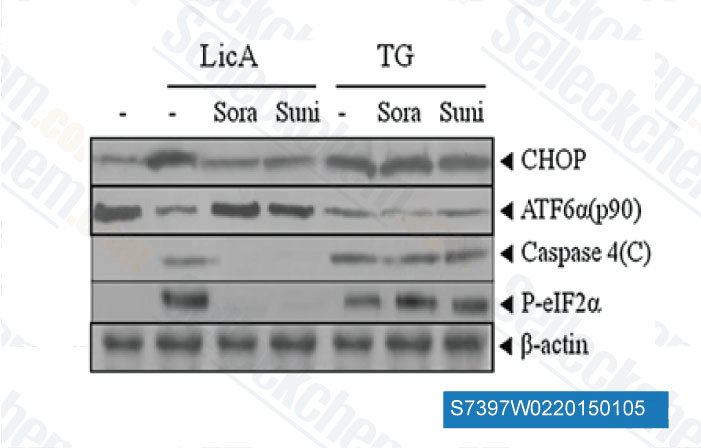
-
Datos de [ Apoptosis , 2014 , 19(4), 682-97 ]
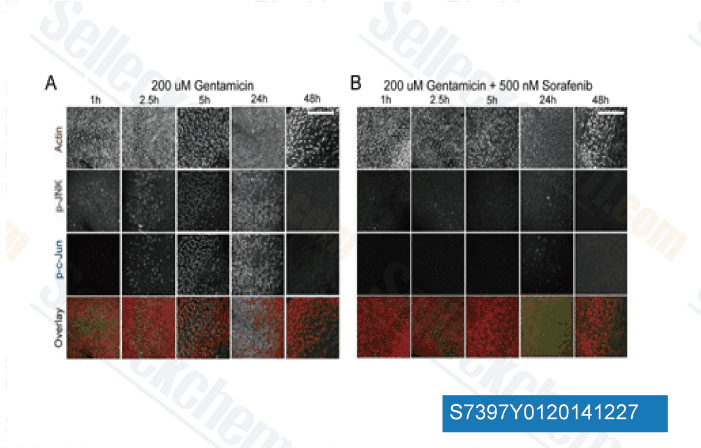
-
Datos de [ J Neurosci , 2013 , 33(7), 3079-93 ]
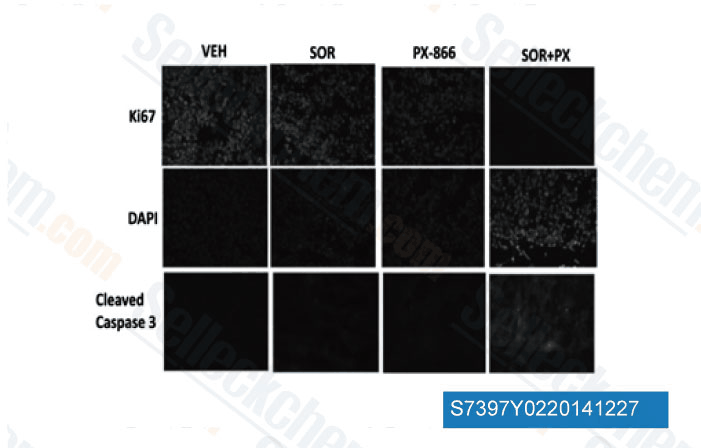
-
Datos de [ Mol Pharmacol , 2013 , 84(4), 562-71 ]
Sellecks Sorafenib (BAY 43-9006) Ha sido citado por 599 Publicaciones
| Sorafenib enhanced the function of myeloid-derived suppressor cells in hepatocellular carcinoma by facilitating PPARα-mediated fatty acid oxidation [ Mol Cancer, 2025, 24(1):34] | PubMed: 39876004 |
| S100P is a ferroptosis suppressor to facilitate hepatocellular carcinoma development by rewiring lipid metabolism [ Nat Commun, 2025, 16(1):509] | PubMed: 39779666 |
| PIP5K1A Suppresses Ferroptosis and Induces Sorafenib Resistance by Stabilizing NRF2 in Hepatocellular Carcinoma [ Adv Sci (Weinh), 2025, 12(30):e04372] | PubMed: 40405713 |
| Injectable SF-platform orchestrates GPX4-targeted ferroptosis-autophagy-immunogenic circuit for overcoming oxidative resistance in triple-negative breast cancer [ Theranostics, 2025, 15(17):8757-8778] | PubMed: 40963899 |
| FLT3 inhibitors induce p53 instability, driven by STAT5/MDM2/p53 competitive interactions in acute myeloid leukemia [ Cancer Lett, 2025, 611:217446] | PubMed: 39756787 |
| In vivo optoacoustic imaging of endothelin receptor expression and treatment response in the hypoxic tumor microenvironment [ Eur J Nucl Med Mol Imaging, 2025, 10.1007/s00259-025-07494-7] | PubMed: 40802092 |
| Matrix stiffness regulates glucose-6-phosphate dehydrogenase expression to mediate sorafenib resistance in hepatocellular carcinoma through the ITGB1-PI3K/AKT pathway [ Cell Death Dis, 2025, 16(1):538] | PubMed: 40685383 |
| Inhibition of Wnt/β-catenin increases anti-tumor activity by synergizing with sorafenib in hepatocellular carcinoma [ Cell Death Dis, 2025, 16(1):466] | PubMed: 40593458 |
| Targeting PTGDS Promotes ferroptosis in peripheral T cell lymphoma through regulating HMOX1-mediated iron metabolism [ Br J Cancer, 2025, 132(4):384-400] | PubMed: 39706989 |
| Targeting the MYC oncogene with a selective bi-steric mTORC1 inhibitor elicits tumor regression in MYC-driven cancers [ Cell Chem Biol, 2025, 32(8):994-1012.e11] | PubMed: 40803322 |
POLÍTICA DE DEVOLUCIÓN
La Política de Devolución Incondicional de Selleck Chemical garantiza una experiencia de compra en línea fluida para nuestros clientes. Si no está satisfecho con su compra de alguna manera, puede devolver cualquier artículo(s) dentro de los 7 días posteriores a su recepción. En caso de problemas de calidad del producto, ya sean problemas relacionados con el protocolo o con el producto, puede devolver cualquier artículo(s) dentro de los 365 días a partir de la fecha de compra original. Siga las instrucciones a continuación al devolver productos.
ENVÍO Y ALMACENAMIENTO
Los productos Selleck se transportan a temperatura ambiente. Si recibe el producto a temperatura ambiente, tenga la seguridad de que el Departamento de Inspección de Calidad de Selleck ha realizado experimentos para verificar que la colocación a temperatura normal durante un mes no afectará la actividad biológica de los productos en polvo. Después de la recogida, guarde el producto de acuerdo con los requisitos descritos en la hoja de datos. La mayoría de los productos Selleck son estables en las condiciones recomendadas.
NO PARA USO HUMANO, DIAGNÓSTICO VETERINARIO O TERAPÉUTICO.
