Datos técnicos
| Fórmula | C15H16ClN5 |
||||||||||
| Peso molecular | 301.77 | Número CAS | 172889-27-9 | ||||||||
| Solubilidad (25°C)* | In vitro | DMSO | 9 mg/mL (29.82 mM) | ||||||||
| Ethanol | 4 mg/mL (13.25 mM) | ||||||||||
| Water | Insoluble | ||||||||||
| In vivo (Agregue los solventes al producto individualmente y en orden.) |
|
||||||||||
|
* <1 mg/ml significa ligeramente soluble o insoluble. * Tenga en cuenta que Selleck prueba la solubilidad de todos los compuestos internamente, y la solubilidad real puede diferir ligeramente de los valores publicados. Esto es normal y se debe a ligeras variaciones entre lotes. * Envío a temperatura ambiente (Las pruebas de estabilidad demuestran que este producto se puede enviar sin medidas de refrigeración.) |
|||||||||||
Preparación de soluciones madre
Actividad biológica
| Descripción | PP2 (AG 1879, AGL 1879), un inhibidor de la quinasa de la familia Src, inhibe potentemente Lck/Fyn con IC50 de 4 nM/5 nM en ensayos libres de células, ~100 veces menos potente para EGFR, inactivo para ZAP-70, JAK2 y PKA. | ||||
|---|---|---|---|---|---|
| Objetivos |
|
||||
| In vitro | PP2 inhibe Src uniéndose a un área de la molécula que no se superpone con el dominio de unión a ATP. Este compuesto (20 μM) induce una inhibición del crecimiento del 40-50% de las células HT29, esta concentración reduce la actividad de Src tan pronto como 1 hora y mantiene una inhibición del 35% de la actividad de Src durante 2 días. Él (100 mM) disminuye la actividad de Src de las células HT29 de manera dosis-dependiente. Este químico (1 mM-100 mM) causa una inhibición del crecimiento dosis-dependiente de células de cáncer de colon humano (HT29, SW480 y PMCO1), células de cáncer de hígado (PLC/PRF/5, KYN-2, Li7 y HepG2) y células de cáncer de mama (MCF-7, MDA-MB-468 y BT-474). Él (20 μM) aumenta significativamente la agregación en la mayoría de las células cancerosas (HT29, SW480, PMCO1, PLC/PRF/5, KYN-2, Li7, MCF-7 y MDA-MB-468) de manera dependiente de E-cadherina. Este compuesto (20 μM) mejora la expresión de E-cadherina y también aumenta fuertemente la asociación de E-cadherina con el citoesqueleto de actina en las células cancerosas. Él (20 μM) aumenta la expresión de α-catenina, β-catenina y γ-catenina en las células HT29, mientras que en las células PLC/PRF/5 y MCF-7, el nivel total de proteína de α-catenina no cambia, pero los niveles de β-catenina y γ-catenina aumentan ligeramente. Este inhibidor inhibe la proliferación de dos células de cáncer cervical (HeLa y SiHa) de manera dependiente del tiempo y la dosis. Él (10 μM) regula a la baja los niveles de expresión de pSrc-Y416, pEGFR-Y845 y -Y1173 en las células HeLa y SiHa. Este químico (10 μM) podría modular la detención del ciclo celular al regular al alza p21(Cip1) y p27(Kip1) en ambas células HeLa y SiHa y al regular a la baja la expresión de ciclina A y quinasa dependiente de ciclina-2, -4 (Cdk-2, -4) en HeLa y de ciclina B y Cdk-2 en SiHa. |
||||
| In vivo | PP2 (5 mg/kg/día) induce cierta ralentización en la tasa de crecimiento de los tumores primarios en relación con el control tratado con vehículo en ratones SCID inoculados con células HT29 en el bazo. Este compuesto induce cierta ralentización en la tasa de crecimiento de los tumores primarios en relación con el control tratado con vehículo en ratones SCID inoculados con células HT29 en el bazo. Este químico reduce significativamente el peso relativo del hígado y el volumen de metástasis hepáticas en comparación con los controles en ratones SCID inoculados con células HT29 en el bazo. Ratas tratadas con este compuesto (1,5 mg/kg i.p.) muestran una reducción aproximada del 50% del tamaño del infarto en la resonancia magnética ponderada en T2 y en la tinción con TTC en comparación con los controles en ratas con lesión cerebral isquémica focal. Este químico resulta en una mejor puntuación neurológica que los controles en ratas con lesión cerebral isquémica focal. |
Protocolo (de referencia)
| Ensayo de quinasa: |
|
|---|---|
| Ensayo celular: |
|
| Estudio en animales: |
|
Referencias
|
Validación de productos por parte del cliente

-
Datos de [ , , J Biol Chem, 2014, 289(19): 13026-41 ]

-
Datos de [ , , CNS Neurosci Ther, 2017, 23(4):291-300 ]
-
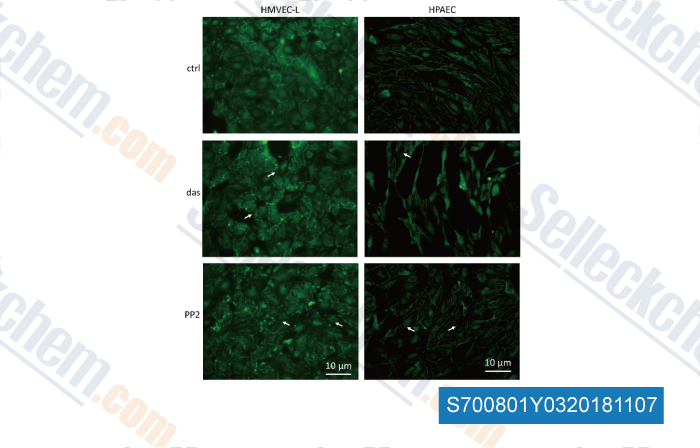
Datos de [ , , Front Physiol, 2018, 9: 537 ]
Sellecks PP2 (AGL 1879) Ha sido citado por 128 Publicaciones
| VCP downstream metabolite glycerol-3-phosphate (G3P) inhibits CD8+T cells function in the HCC microenvironment [ Signal Transduct Target Ther, 2025, 10(1):26] | PubMed: 39848960 |
| Intrinsic p53 activation restricts gammaherpesvirus driven germinal center B cell expansion during latency establishment [ Nat Commun, 2025, 16(1):951] | PubMed: 39843898 |
| TBK1 phagosomal recruitment enhances antifungal immunity via positive feedback regulation with SRC [ Cell Rep, 2025, 44(7):115972] | PubMed: 40638388 |
| Activation of integrin signaling up-regulates pro-inflammatory cytokines in JAK2-V617F positive hematopoietic cells [ Cell Commun Signal, 2025, 23(1):368] | PubMed: 40790213 |
| Anthrax ET activates Rac1 and RTK signaling to induce F-actin reorganization and endothelial permeability [ iScience, 2025, 28(11):113682] | PubMed: 41158867 |
| ICAM-1-mediated Src signaling pathway plays a pivotal role in encephalomyocarditis virus entry [ J Virol, 2025, 99(8):e0071525] | PubMed: 40631914 |
| Asiaticoside enhances the anti-tumor effect of anti-PDL1 by regulating T cell activity through increasing LCK activity [ Pathol Res Pract, 2025, 271:155995] | PubMed: 40373489 |
| Identification of hypoxic macrophages in glioblastoma with therapeutic potential for vasculature normalization [ Cancer Cell, 2024, S1535-6108(24)00119-3] | PubMed: 38640932 |
| Defective N-glycosylation of IL6 induces metastasis and tyrosine kinase inhibitor resistance in lung cancer [ Nat Commun, 2024, 15(1):7885] | PubMed: 39251588 |
| Guided monocyte fate to FRβ/CD163+ S1 macrophage antagonises atopic dermatitis via fibroblastic matrices in mouse hypodermis [ Cell Mol Life Sci, 2024, 82(1):14] | PubMed: 39720957 |
POLÍTICA DE DEVOLUCIÓN
La Política de Devolución Incondicional de Selleck Chemical garantiza una experiencia de compra en línea fluida para nuestros clientes. Si no está satisfecho con su compra de alguna manera, puede devolver cualquier artículo(s) dentro de los 7 días posteriores a su recepción. En caso de problemas de calidad del producto, ya sean problemas relacionados con el protocolo o con el producto, puede devolver cualquier artículo(s) dentro de los 365 días a partir de la fecha de compra original. Siga las instrucciones a continuación al devolver productos.
ENVÍO Y ALMACENAMIENTO
Los productos Selleck se transportan a temperatura ambiente. Si recibe el producto a temperatura ambiente, tenga la seguridad de que el Departamento de Inspección de Calidad de Selleck ha realizado experimentos para verificar que la colocación a temperatura normal durante un mes no afectará la actividad biológica de los productos en polvo. Después de la recogida, guarde el producto de acuerdo con los requisitos descritos en la hoja de datos. La mayoría de los productos Selleck son estables en las condiciones recomendadas.
NO PARA USO HUMANO, DIAGNÓSTICO VETERINARIO O TERAPÉUTICO.
