Datos técnicos
| Fórmula | C27H28F2N6O.2HCl |
||||||
| Peso molecular | 563.47 | Número CAS | 1942919-79-0 | ||||
| Solubilidad (25°C)* | In vitro | DMSO | 113 mg/mL (200.54 mM) | ||||
| Ethanol | 15 mg/mL (26.62 mM) | ||||||
| Water | 3 mg/mL (5.32 mM) | ||||||
| In vivo (Agregue los solventes al producto individualmente y en orden.) |
|
||||||
|
* <1 mg/ml significa ligeramente soluble o insoluble. * Tenga en cuenta que Selleck prueba la solubilidad de todos los compuestos internamente, y la solubilidad real puede diferir ligeramente de los valores publicados. Esto es normal y se debe a ligeras variaciones entre lotes. * Envío a temperatura ambiente (Las pruebas de estabilidad demuestran que este producto se puede enviar sin medidas de refrigeración.) |
|||||||
Preparación de soluciones madre
Actividad biológica
| Descripción | NVP-BSK805 2HCl es un potente y selectivo inhibidor de JAK2 competitivo con ATP con un IC50 de 0,5 nM, >20 veces de selectividad hacia JAK1, JAK3 y TYK2. | ||||||||
|---|---|---|---|---|---|---|---|---|---|
| Objetivos |
|
||||||||
| In vitro | Se ha descubierto que NVP-BSK805 inhibe potentemente JAK2, mostrando una selectividad superior a 20 veces hacia JAK1, JAK3 y TYK2. NVP-BSK805 provoca una inhibición semimáxima de las enzimas JAK2V617F de longitud completa y JAK2 de tipo salvaje a 0,5 nM. NVP-BSK805 bloquea el crecimiento de células JAK2V617F (Ba/F3) e induce la apoptosis con un GI50 a concentraciones <100 nM. Dado que la fosforilación constitutiva de STAT5 depende de JAK2, se ha descubierto que NVP-BSK805 suprime potentemente la fosforilación de STAT5 a concentraciones ">= 100 nM en las líneas celulares mutantes JAK2V617F, como MB-02. La incubación de células SET-2 con 150 nM y 1 µM de NVP-BSK805, lo que corresponde a concentraciones que producen una inhibición del crecimiento del 75 % y el 95 %, respectivamente, durante 24, 48 y 72 horas, conduce a una inducción de la apoptosis dependiente de la concentración y el tiempo. Estos resultados se evidencian por la detección de PARP clivado, la expresión reducida de Bcl-xL y un fuerte aumento en el número de células con menos de 2N de contenido de ADN. La muerte celular desencadenada por NVP-BSK805 requiere la activación de cascadas de caspasas y se supera mediante la inhibición de las caspasas tanto en células SET-2 como en MB-02. NVP-BSK805 modula la modificación postraduccional de Bim y los niveles de Mcl-1 en células JAK2V617F, células SET-2 y MB-02. | ||||||||
| In vivo | La biodisponibilidad oral de NVP-BSK805 en ratones se estima en un 45 %, mientras que en ratas es del 50 %. La administración oral de NVP-BSK805 a 150 mg/kg suprime la fosforilación de STAT5, la esplenomegalia y la propagación de células leucémicas en un modelo de ratón impulsado por células Ba/F3 JAK2V617F. NVP-BSK805 suprime la fosforilación de STAT5 inducida por rhEpo, así como la policitemia y la esplenomegalia mediadas por rhEpo en ratones BALB/c a dosis orales de 25, 50 y 100 mg/kg. |
Protocolo (de referencia)
| Ensayo de quinasa:[1] |
|
|---|---|
| Ensayo celular:[1] |
|
| Estudio en animales:[1] |
|
Referencias
|
Validación de productos por parte del cliente
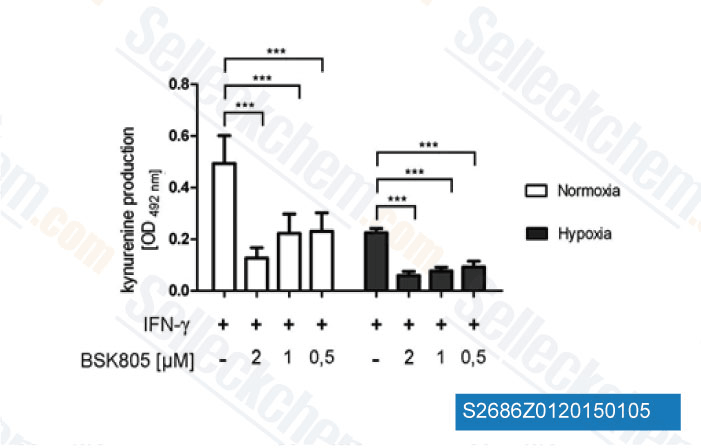
-
Datos de [ PLoS One , 2013 , 8(5), e63301 ]
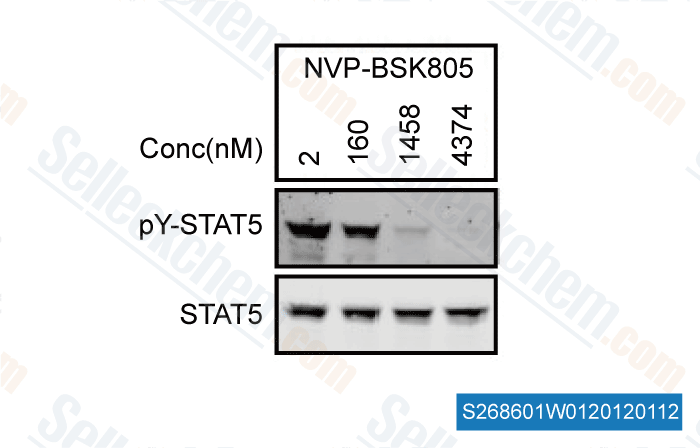
-
, , Dr. Catherine Rolvering and Dr. Claude Haan of Université du Luxembour
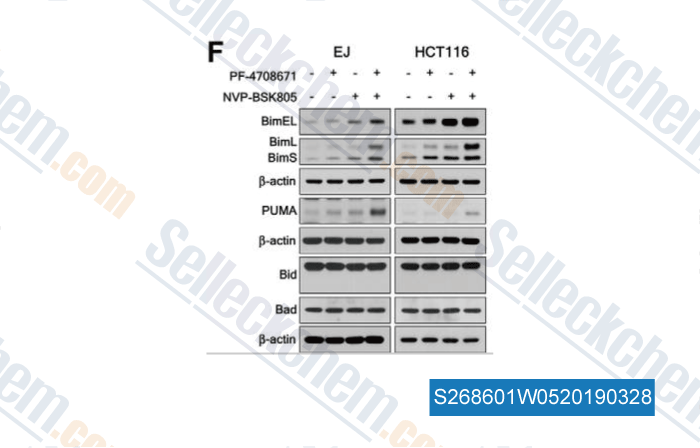
-
Datos de [ , , J Biol Chem, 2015, 290(39):23553-62 ]
Sellecks NVP-BSK805 2HCl Ha sido citado por 15 Publicaciones
| GM-CSF engages multiple signaling pathways to enhance pro-inflammatory cytokine responses in human monocytes during Legionella infection [ bioRxiv, 2024, 2024.12.05.627084] | PubMed: 39713445 |
| JAK2 Inhibitor, Fedratinib, Inhibits P-gp Activity and Co-Treatment Induces Cytotoxicity in Antimitotic Drug-Treated P-gp Overexpressing Resistant KBV20C Cancer Cells [ Int J Mol Sci, 2022, 23(9)4597] | PubMed: 35562984 |
| Establishment and characterization of immortalized sweat gland myoepithelial cells [ Sci Rep, 2022, 12(1):7] | PubMed: 34997030 |
| Interleukin 6 trans-signaling is a critical driver of lung allograft fibrosis [ Am J Transplant, 2021, 21(7):2360-2371] | PubMed: 33249747 |
| CXCL10/CXCR3 signaling contributes to an inflammatory microenvironment and its blockade enhances progression of murine pancreatic precancerous lesions [ Elife, 2021, 10e60646] | PubMed: 34328416 |
| IL-6 derived from therapy-induced senescence facilitates the glycolytic phenotype in glioblastoma cells [ Am J Cancer Res, 2021, 11(2):458-478] | PubMed: 33575081 |
| A Single-Cell Landscape of High-Grade Serous Ovarian Cancer [ Nat Med, 2020, 10.1038/s41591-020-0926-0] | PubMed: 32572264 |
| Revisiting Aldehyde Oxidase Mediated Metabolism in Drug-like Molecules: An Improved Computational Model [ J Med Chem, 2020, 31] | PubMed: 32191458 |
| Stomatin-like Protein 2 Promotes Tumor Cell Survival by Activating the JAK2-STAT3-PIM1 Pathway, Suggesting a Novel Therapy in CRC. [ Mol Ther Oncolytics, 2020, 30;17:169-179] | PubMed: 32346607 |
| STAT3/5 Inhibitors Suppress Proliferation in Bladder Cancer and Enhance Oncolytic Adenovirus Therapy. [ Int J Mol Sci, 2020, 21(3)] | PubMed: 32046095 |
POLÍTICA DE DEVOLUCIÓN
La Política de Devolución Incondicional de Selleck Chemical garantiza una experiencia de compra en línea fluida para nuestros clientes. Si no está satisfecho con su compra de alguna manera, puede devolver cualquier artículo(s) dentro de los 7 días posteriores a su recepción. En caso de problemas de calidad del producto, ya sean problemas relacionados con el protocolo o con el producto, puede devolver cualquier artículo(s) dentro de los 365 días a partir de la fecha de compra original. Siga las instrucciones a continuación al devolver productos.
ENVÍO Y ALMACENAMIENTO
Los productos Selleck se transportan a temperatura ambiente. Si recibe el producto a temperatura ambiente, tenga la seguridad de que el Departamento de Inspección de Calidad de Selleck ha realizado experimentos para verificar que la colocación a temperatura normal durante un mes no afectará la actividad biológica de los productos en polvo. Después de la recogida, guarde el producto de acuerdo con los requisitos descritos en la hoja de datos. La mayoría de los productos Selleck son estables en las condiciones recomendadas.
NO PARA USO HUMANO, DIAGNÓSTICO VETERINARIO O TERAPÉUTICO.
