Datos técnicos
| Fórmula | C13H13N3OS |
||||||
| Peso molecular | 259.33 | Número CAS | 4311-88-0 | ||||
| Solubilidad (25°C)* | In vitro | DMSO | 51 mg/mL (196.66 mM) | ||||
| Water | Insoluble | ||||||
| Ethanol | Insoluble | ||||||
| In vivo (Agregue los solventes al producto individualmente y en orden.) |
|
||||||
|
* <1 mg/ml significa ligeramente soluble o insoluble. * Tenga en cuenta que Selleck prueba la solubilidad de todos los compuestos internamente, y la solubilidad real puede diferir ligeramente de los valores publicados. Esto es normal y se debe a ligeras variaciones entre lotes. * Envío a temperatura ambiente (Las pruebas de estabilidad demuestran que este producto se puede enviar sin medidas de refrigeración.) |
|||||||
Preparación de soluciones madre
Actividad biológica
| Descripción | Necrostatin-1 (Nec-1) es un inhibidor específico de RIP1 (RIPK1) e inhibe la necroptosis inducida por TNF-α con un EC50 de 490 nM en células 293T. Necrostatin-1 también bloquea IDO y suprime la autophagy y la apoptosis. | ||||
|---|---|---|---|---|---|
| Objetivos |
|
||||
| In vitro | Necrostatin-1 (1-100 μM) inhibe la autofosforilación de RIP1 sobreexpresada y endógena. Se ha encontrado que RIP1 es el objetivo celular primario responsable de la actividad antinecroptosis de este compuesto. Este químico suprime eficientemente la muerte celular necroptótica desencadenada por una variedad de estímulos en una variedad de tipos celulares. Previamente identificado como un inhibidor de moléculas pequeñas de la necroptosis, inhibe la necroptosis inducida por RIP kinase e inhibe la necroptosis inducida por TNF-α en células Jurkat con una EC50 de 490 nM. |
||||
| In vivo | Necrostatin-1 (Nec-1) es un inhibidor de molécula pequeña específico de la quinasa 1 (RIPK1) que interactúa con el receptor y que inhibe específicamente la fosforilación de este compuesto. |
||||
| Características | Una herramienta potente para caracterizar el papel de la necroptosis con un objetivo primario caracterizado. |
Protocolo (de referencia)
| Ensayo de quinasa: |
|
|---|---|
| Ensayo celular: |
|
| Estudio en animales: |
|
Referencias
|
Validación de productos por parte del cliente
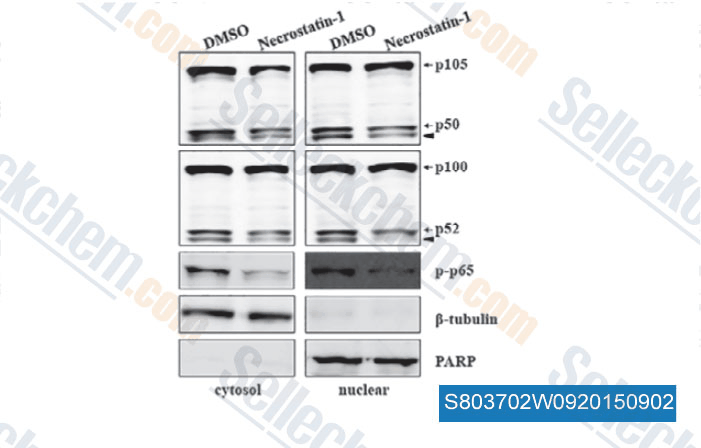
-
Datos de [ , , J Cell Mol Med, 2015, 19(5): 1042-54 ]
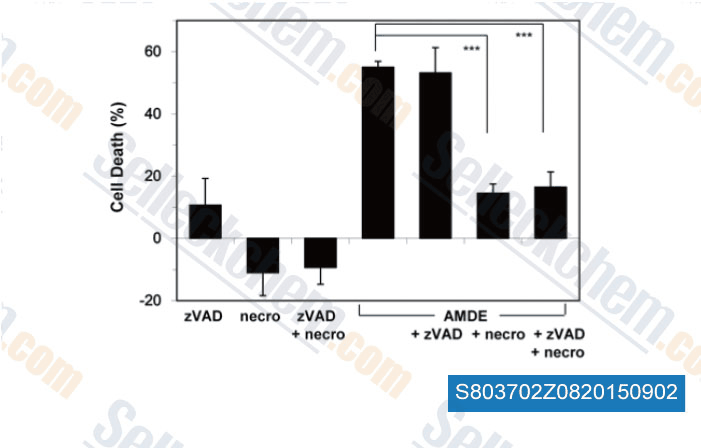
-
Datos de [ , , PLoS One, 2015, 10(3): e0122083 ]
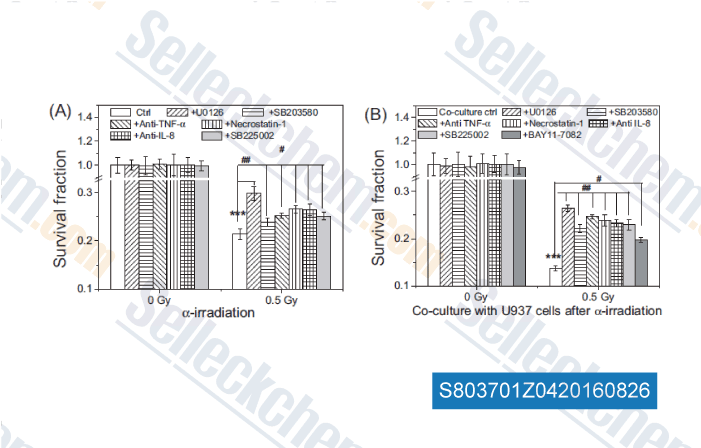
-
Datos de [ , , Mutation Research, 2016, 789:1-8. ]
Sellecks Necrostatin-1 (Nec-1) Ha sido citado por 321 Publicaciones
| Soluble tissue factor generated by necroptosis-triggered shedding is responsible for thrombosis [ Cell Res, 2025, 10.1038/s41422-025-01167-8] | PubMed: 40940518 |
| The noncanonical function of liver-type phosphofructokinase potentiates the efficacy of HDAC inhibitors in cancer [ Signal Transduct Target Ther, 2025, 10(1):341] | PubMed: 41083431 |
| LINE-1 ORF1p Mimics Viral Innate Immune Evasion Mechanisms in Pancreatic Ductal Adenocarcinoma [ Cancer Discov, 2025, 10.1158/2159-8290.CD-24-1317] | PubMed: 39919290 |
| Ferroptosis-activating metabolite acrolein antagonizes necroptosis and anti-cancer therapeutics [ Nat Commun, 2025, 16(1):4919] | PubMed: 40425585 |
| Harnessing the FGFR2/NF2/YAP signaling-dependent necroptosis to develop an FGFR2/IL-8 dual blockade therapeutic strategy [ Nat Commun, 2025, 16(1):4128] | PubMed: 40319089 |
| Targeting pancreatic cancer glutamine dependency confers vulnerability to GPX4-dependent ferroptosis [ Cell Rep Med, 2025, 6(2):101928] | PubMed: 39879992 |
| GCLC desuccinylation regulated by oxidative stress protects human cancer cells from ferroptosis [ Cell Death Differ, 2025, 32(9):1679-1690] | PubMed: 40188196 |
| Carbon ion combined photon radiotherapy induces ferroptosis via NCOA4-mediated ferritinophagy in glioblastoma [ Redox Biol, 2025, 86:103865] | PubMed: 40925125 |
| SLC25A1 and ACLY maintain cytosolic acetyl-CoA and regulate ferroptosis susceptibility via FSP1 acetylation [ EMBO J, 2025, 10.1038/s44318-025-00369-5] | PubMed: 39881208 |
| Akt isoform specificity drives intrinsic immune regulation during HSV-1 infection [ Proc Natl Acad Sci U S A, 2025, 122(27):e2504962122] | PubMed: 40601626 |
POLÍTICA DE DEVOLUCIÓN
La Política de Devolución Incondicional de Selleck Chemical garantiza una experiencia de compra en línea fluida para nuestros clientes. Si no está satisfecho con su compra de alguna manera, puede devolver cualquier artículo(s) dentro de los 7 días posteriores a su recepción. En caso de problemas de calidad del producto, ya sean problemas relacionados con el protocolo o con el producto, puede devolver cualquier artículo(s) dentro de los 365 días a partir de la fecha de compra original. Siga las instrucciones a continuación al devolver productos.
ENVÍO Y ALMACENAMIENTO
Los productos Selleck se transportan a temperatura ambiente. Si recibe el producto a temperatura ambiente, tenga la seguridad de que el Departamento de Inspección de Calidad de Selleck ha realizado experimentos para verificar que la colocación a temperatura normal durante un mes no afectará la actividad biológica de los productos en polvo. Después de la recogida, guarde el producto de acuerdo con los requisitos descritos en la hoja de datos. La mayoría de los productos Selleck son estables en las condiciones recomendadas.
NO PARA USO HUMANO, DIAGNÓSTICO VETERINARIO O TERAPÉUTICO.
