Datos técnicos
| Fórmula | C22H21ClFN3O3S |
||||||||||
| Peso molecular | 461.94 | Número CAS | 1010085-13-8 | ||||||||
| Solubilidad (25°C)* | In vitro | DMSO | 92 mg/mL (199.16 mM) | ||||||||
| Water | Insoluble | ||||||||||
| Ethanol | Insoluble | ||||||||||
| In vivo (Agregue los solventes al producto individualmente y en orden.) |
|
||||||||||
|
* <1 mg/ml significa ligeramente soluble o insoluble. * Tenga en cuenta que Selleck prueba la solubilidad de todos los compuestos internamente, y la solubilidad real puede diferir ligeramente de los valores publicados. Esto es normal y se debe a ligeras variaciones entre lotes. * Envío a temperatura ambiente (Las pruebas de estabilidad demuestran que este producto se puede enviar sin medidas de refrigeración.) |
|||||||||||
Preparación de soluciones madre
Actividad biológica
| Descripción | MK-5108 (VX-689) es un inhibidor altamente selectivo de Aurora A con una IC50 de 0,064 nM en un ensayo sin células y es 220 y 190 veces más selectivo para Aurora A que para Aurora B/C, mientras que inhibe TrkA con menos de 100 veces de selectividad. Este compuesto induce Autophagy. Fase 1. | ||
|---|---|---|---|
| Objetivos |
|
||
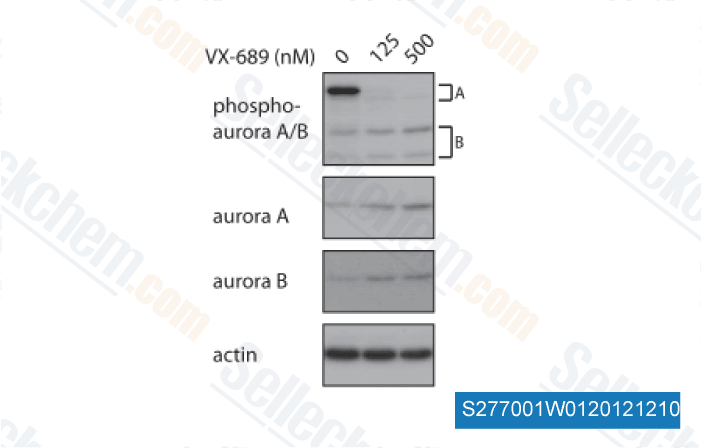
| In vitro | MK-5108 inhibe la actividad de Aurora-A de manera competitiva con el ATP. Este compuesto muestra una robusta selectividad contra las otras quinasas de la familia Aurora-B (220 veces) y Aurora-C (190 veces) en el ensayo bioquímico. También revela una alta selectividad para Aurora-A sobre otras proteínas quinasas. El compuesto inhibe solo una quinasa (TrkA) con una selectividad <100 veces. Puede ser más selectivo para Aurora-A que MLN8054. Consistente con la inducción de células pHH3-positivas, este químico induce la acumulación de células en la fase G2-M. Inhibe la proliferación de células tumorales, incluyendo HCC1143, AU565, MCF-7, HCC1806 y CAL85-1 con una IC50 de 0,42 μM, 0,45 μM, 0,52 μM, 0,56μM y 0,74 μM, respectivamente. Este compuesto disminuye la viabilidad celular de forma dosis-dependiente en las tres líneas celulares, incluidas las células LEIO285, LEIO505 y SK-LSM1, con una IC50 de aproximadamente 100 nM. La incubación con él en LEIO285 aumenta la proporción de células en G2/M a las 48 y 72 horas post-tratamiento. El compuesto aumenta significativamente la actividad de la Caspasa 3/7 en comparación con los cultivos control tratados con DMSO en ambos puntos de tiempo. En las células LEIO505, provoca una mayor acumulación de células en las fases G2/M a las 24 horas, pero no a las 48 o 72 horas. |
||
| In vivo | MK-5108 induce células pHH3-positivas a dosis de 16 mg/kg y 32 mg/kg. La concentración plasmática de este compuesto a 8 mg/kg y 16 mg/kg es de 1,7 μM y 4,4 μM, respectivamente. El tratamiento con este compuesto da como resultado la inducción de pHH3 en tejidos tumorales y cutáneos, que comienza a las 2 horas y alcanza un máximo a las 4 horas. Los tratamientos químicos a 15 mg/kg y 30 mg/kg dan como resultado una inhibición significativa del crecimiento tumoral con un cambio en el volumen tumoral medio para el grupo de tratamiento como porcentaje del cambio medio en el grupo control (%T/C) del 10 % y −6 % en el día 11, y 17 % y 5 % en el día 18, respectivamente. Se tolera bien en ambas dosis, con una reducción mínima del peso corporal. Este compuesto también exhibe una actividad antitumoral significativa a través de la dosificación intermitente en ratas desnudas portadoras de tumores SW48; a 15 mg/kg y 45 mg/kg causa una inhibición del crecimiento tumoral dosis-dependiente con un %T/C del 35 % y 7 % en el día 10, y 58 % y 32 % en el día 27, respectivamente. |
Protocolo (de referencia)
| Ensayo de quinasa: |
|
|---|---|
| Ensayo celular: |
|
| Estudio en animales: |
|
Referencias
|
Validación de productos por parte del cliente
-S277001W0220130927.gif)
-
Datos de [ Oncogene , 2014 , 33, 3550-60 ]

-
Datos de [ Cancer Discov , 2013 , 10.1158/2159-8290.CD-12-0426 ]
![P53 expression in the 14G2a mAb-treated IMR-32 cell line and after combinatorial treatment with MK-5108 inhibitor. P53 protein content was measured in whole cell-WCE (A), cytoplasmic-CE (C) and nuclear-NE (E) extracts at 2, 6, 24 and 48 h after 14G2a addition (40 ug/ml) into culture media of IMR-32 cells, and normalized to GAPDH levels (for WCE and CE), or TBP (for NE). Mean values of three separate experiments (盨EM) obtained for the 14G2a mAb-treated cells are shown as empty bars, and calculated versus control value, set as 1 (black baseline). ANOVA shows no statistically significant changes of P53 level in time in IMR-32 WCE [F(3, 9) = 1.35, p = 0.3181]. Statistically significant changes of P53 level in time were found in CE [F(3, 6) = 53.76, p = 0.0001], and in NE [F(3, 6) = 63.17, p = 0.0001], as compared to 2 h time point. P53 expression level was measured in whole cell-WCE (B), cytoplasmic-CE (D) and nuclear-NE (F) extracts at 2 and 24 h after the 14G2a mAb treatment alone (white bars with black stripes) or in combination with MK-5108 inhibitor (black bars with white stripes), and normalized to GAPDH levels (for WCE and CE), or TBP (for NE). Below each chart representative immunoblottings are presented; C-control cells; mAb-the 14G2a mAb-treated cells; I + mAb-MK-5108 inhibitor and the mAb-treated cells. P-values for t-test were as follow: p < 0.05 (*), p < 0.01 (**), p < 0.001 (***).](https://file.selleckchem.com/downloads/review/700px/VX-689-S2770W0220150108.gif)
-
Datos de [ Cancer Lett , 2013 , 341(2), 248-64 ]
-
, , Ken Ma Hong Kong University of Science & Technology
Sellecks MK-5108 Ha sido citado por 41 Publicaciones
| Establishment, characterization, and biobanking of 36 pancreatic cancer organoids: prediction of metastasis in resectable pancreatic cancer [ Cell Oncol (Dordr), 2024, 10.1007/s13402-024-00939-5] | PubMed: 38619751 |
| Inhibition of epigenetic and cell cycle-related targets in glioblastoma cell lines reveals that onametostat reduces proliferation and viability in both normoxic and hypoxic conditions [ Sci Rep, 2024, 14(1):4303] | PubMed: 38383756 |
| Exploiting ulnerabilities induced b recurrent mutations in chondrosarcoma and giant cell tumour of bone: therapeutic targeting of the altered epigenome and be [ Leiden University The Netherlands, 2023, ] | PubMed: None |
| Spatially distinct inputs modulate the amount of active Mitotic-phase GAP to locally restrict RhoA signaling for successful cell division [ bioRxiv, 2023, 10.1101/2023.08.08.552464] | PubMed: None |
| Revisiting the Resazurin-Based Sensing of Cellular Viability: Widening the Application Horizon [ Biosensors (Basel), 2022, 12(4)196] | PubMed: 35448256 |
| Culture and multiomic analysis of lung cancer patient-derived pleural effusions revealed distinct druggable molecular types [ Sci Rep, 2022, 12(1):6345] | PubMed: 35428753 |
| 選択的オーロラキナーゼ A 阻害剤 TAS-119 を用いたオーロラキナーゼ A 阻害剤の薬剤感受性マーカーの探索 [ , 2022, ] | PubMed: none |
| Targeting Aurora B kinase prevents and overcomes resistance to EGFR inhibitors in lung cancer by enhancing BIM- and PUMA-mediated apoptosis [ Cancer Cell, 2021, S1535-6108(21)00383-4] | PubMed: 34388376 |
| Multifocal Organoid Capturing of Colon Cancer Reveals Pervasive Intratumoral Heterogenous Drug Responses [ Adv Sci (Weinh), 2021, e2103360] | PubMed: 34918496 |
| Size-Selective VAILase Proteolysis Provides Dynamic Insights into Protein Structures [ Anal Chem, 2021, 93(30):10653-10660] | PubMed: 34291915 |
POLÍTICA DE DEVOLUCIÓN
La Política de Devolución Incondicional de Selleck Chemical garantiza una experiencia de compra en línea fluida para nuestros clientes. Si no está satisfecho con su compra de alguna manera, puede devolver cualquier artículo(s) dentro de los 7 días posteriores a su recepción. En caso de problemas de calidad del producto, ya sean problemas relacionados con el protocolo o con el producto, puede devolver cualquier artículo(s) dentro de los 365 días a partir de la fecha de compra original. Siga las instrucciones a continuación al devolver productos.
ENVÍO Y ALMACENAMIENTO
Los productos Selleck se transportan a temperatura ambiente. Si recibe el producto a temperatura ambiente, tenga la seguridad de que el Departamento de Inspección de Calidad de Selleck ha realizado experimentos para verificar que la colocación a temperatura normal durante un mes no afectará la actividad biológica de los productos en polvo. Después de la recogida, guarde el producto de acuerdo con los requisitos descritos en la hoja de datos. La mayoría de los productos Selleck son estables en las condiciones recomendadas.
NO PARA USO HUMANO, DIAGNÓSTICO VETERINARIO O TERAPÉUTICO.
