Datos técnicos
| Fórmula | C26H23N5O |
||||||
| Peso molecular | 421.49 | Número CAS | 867160-71-2 | ||||
| Solubilidad (25°C)* | In vitro | DMSO | 84 mg/mL (199.29 mM) | ||||
| Water | Insoluble | ||||||
| Ethanol | Insoluble | ||||||
| In vivo (Agregue los solventes al producto individualmente y en orden.) |
|
||||||
|
* <1 mg/ml significa ligeramente soluble o insoluble. * Tenga en cuenta que Selleck prueba la solubilidad de todos los compuestos internamente, y la solubilidad real puede diferir ligeramente de los valores publicados. Esto es normal y se debe a ligeras variaciones entre lotes. * Envío a temperatura ambiente (Las pruebas de estabilidad demuestran que este producto se puede enviar sin medidas de refrigeración.) |
|||||||
Preparación de soluciones madre
Actividad biológica
| Descripción | Linsitinib (OSI-906) es un inhibidor selectivo de IGF-1R con una IC50 de 35 nM en ensayos libres de células. Es modestamente potente para InsR con una IC50 de 75 nM, y no muestra actividad hacia Abl, ALK, BTK, EGFR, FGFR1/2, PKA, etc. Fase 3. | ||||||
|---|---|---|---|---|---|---|---|
| Objetivos |
|
||||||
| In vitro | Linsitinib (OSI-906) inhibe la autofosforilación de IGF-1R y la activación de las proteínas de señalización aguas abajo Akt, ERK1/2 y S6 quinasa con una IC50 de 0,028 a 0,13 μM. Permite una conformación intermedia de la proteína objetivo a través de interacciones con la hélice C y muestra una estabilidad metabólica favorable en microsomas hepáticos. Este compuesto inhibe completamente la fosforilación tanto de IR como de IGF-1R a una concentración de 1 μM e inhibe la proliferación de varias líneas celulares tumorales, incluyendo el cáncer de pulmón no microcítico y la línea celular tumoral de cáncer colorrectal (CCR) con una EC50 de 0,021 a 0,810 μM. | ||||||
| In vivo | Linsitinib (OSI-906) inhibe el crecimiento tumoral en un modelo de ratón con xenoinjerto impulsado por IGF-1R, con un 100% de TGI y un 55% de regresión a una dosis de 75 mg/kg y un 60% de TGI y ninguna regresión a una dosis de 25 mg/kg. Su administración induce diferentes semividas de eliminación en perro, rata y ratón, que son 1,18 horas, 2,64 horas y 2,14 horas, respectivamente. Cuando se administra en diferentes dosis únicas una vez al día en ratas Sprague-Dawley hembra y ratones CD-1 hembra, revela que la Vmax no es dosis-proporcional a su dosis. Este compuesto eleva los niveles de glucosa en sangre a una dosis de 25 mg/kg después de 12 días de administración. A una dosis única de 75 mg/kg en un modelo de ratón con xenoinjerto de IGF-1R humano de longitud completa (LISN) impulsado por IGF-1R, logra una inhibición máxima de la fosforilación de IGF-1R (80%) entre 4 y 24 horas con concentraciones plasmáticas del fármaco de 26,6-4,77 μM. Cuando se administra como una dosis única de 60 mg/kg en ratones con xenoinjerto NCI-H292, inhibe la captación de glucosa a las 2, 4 y 24 horas post-tratamiento in vivo. También inhibe el crecimiento de tumores en un modelo de ratón con xenoinjerto NCI-H292. |
Protocolo (de referencia)
| Ensayo de quinasa:[1] |
|
|---|---|
| Ensayo celular:[1] |
|
| Estudio en animales:[1] |
|
Referencias
|
Validación de productos por parte del cliente
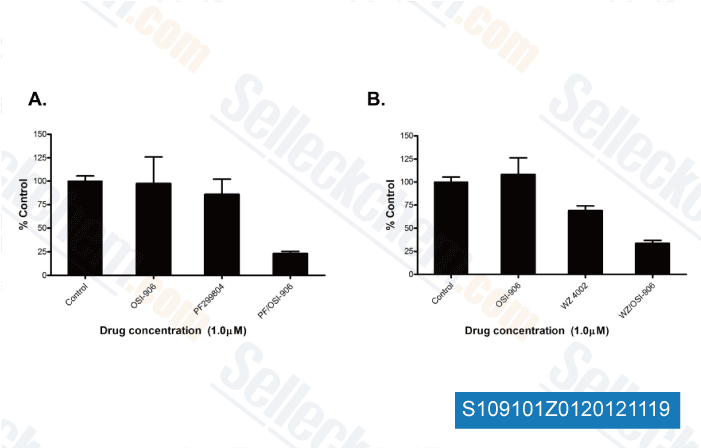
-
Datos de [ Cancer Res , 2013 , 73, 834-843 ]
![<p>OSI-906 prevents the emergence and inhibits growth of established hormone-indendent tumors . A and B, MCF-7 cells were injected s.c. into athymic mice supplemented with 14-day release E2 pellets. Mice with no tumors (A) or bearing tumors ≥ 150 mm<sup>3</sup> (B) were randomized to vehicle or OSI-906 (50 mg/kg/day, per os) for 6 weeks. Data are presented as number of tumors formed ; , P = 0.02, Fisher's exact test (A) , or mean tumor volume ± SEM; P < 0.05 versus vehicle, 2-way ANOVA (B). C, tumor-bearing mice from (A) were treated with vehicle or OSI-906 for 3 days. Xenografts were harvested 4 hours after the last dose. Tumor lysates were precipitated with a p-Tyr antibody; p-Tyr pull- downs and tumor lysates were analyzed by immunoblot with the indicated antibodies. D, tumor-bearing mice were imaged before and 4 hours after the initial dose of OSI- 906 by [18 F]FDG -PET. Images from a representative mouse show [18 F]FDG uptake pre- and post–OSI-906 (T-tumor ). Quantification is shown at the bottom. , P < 0.0001, 2-way ANOVA .</p>](https://file.selleckchem.com/downloads/review/700px/OSI-906-S109101W0120111101.gif)
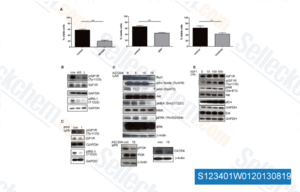
-
Datos de [ Cancer Res , 2011 , 71, 6773-84 ]
-
,
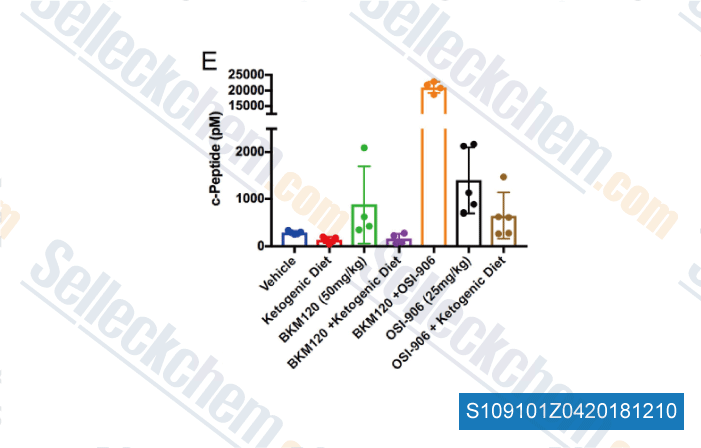
-
Datos de [ , , Nature, 2018, 560(7719):499-503 ]
Sellecks Linsitinib (OSI-906) Ha sido citado por 210 Publicaciones
| Placenta-derived factors contribute to human iPSC-liver organoid growth [ Nat Commun, 2025, 16(1):2493] | PubMed: 40082402 |
| Enhanced regenerative and developmental potential of embryonal and stem cell-derived platelets compared to adult platelets [ Cell Rep Med, 2025, 6(8):102297] | PubMed: 40795844 |
| Imeglimin suppresses glucagon secretion and induces a loss of α cell identity [ Cell Rep Med, 2025, 6(8):102254] | PubMed: 40713970 |
| PI3K-dependent GAB1/Erk phosphorylation renders head and neck squamous cell carcinoma sensitive to PI3Kα inhibitors [ Cell Death Dis, 2025, 16(1):457] | PubMed: 40533463 |
| Linsitinib Decreases Thyrotropin-Induced Thyroid Hormone Synthesis by Inhibiting Crosstalk Between Thyroid-Stimulating Hormone and Insulin-Like Growth Factor 1 Receptors in Human Thyrocytes In Vitro and In Vivo in Mice [ Thyroid, 2025, 35(2):216-224] | PubMed: 39718934 |
| Heparan sulfate fine-tuned interleukin-1 (IL-1) signaling inhibits insulin secretion of grafted pancreatic islets [ Sci Adv, 2025, 11(32):eady8566] | PubMed: 40779638 |
| Hypoxia-induced histone methylation and NF-κB activation in pancreas cancer fibroblasts promote EMT-supportive growth factor secretion [ bioRxiv, 2025, 2025.01.30.635486] | PubMed: 39974981 |
| Disease-relevant upregulation of P2Y1 receptor in astrocytes enhances neuronal excitability via IGFBP2 [ Nat Commun, 2024, 15(1):6525] | PubMed: 39117630 |
| Caloric restriction leads to druggable LSD1-dependent cancer stem cells expansion [ Nat Commun, 2024, 15(1):828] | PubMed: 38280853 |
| Acinar-ductal cell rearrangement drives branching morphogenesis of the murine pancreas in an IGF/PI3K-dependent manner [ Dev Cell, 2024, 59(3):326-338.e5] | PubMed: 38237591 |
POLÍTICA DE DEVOLUCIÓN
La Política de Devolución Incondicional de Selleck Chemical garantiza una experiencia de compra en línea fluida para nuestros clientes. Si no está satisfecho con su compra de alguna manera, puede devolver cualquier artículo(s) dentro de los 7 días posteriores a su recepción. En caso de problemas de calidad del producto, ya sean problemas relacionados con el protocolo o con el producto, puede devolver cualquier artículo(s) dentro de los 365 días a partir de la fecha de compra original. Siga las instrucciones a continuación al devolver productos.
ENVÍO Y ALMACENAMIENTO
Los productos Selleck se transportan a temperatura ambiente. Si recibe el producto a temperatura ambiente, tenga la seguridad de que el Departamento de Inspección de Calidad de Selleck ha realizado experimentos para verificar que la colocación a temperatura normal durante un mes no afectará la actividad biológica de los productos en polvo. Después de la recogida, guarde el producto de acuerdo con los requisitos descritos en la hoja de datos. La mayoría de los productos Selleck son estables en las condiciones recomendadas.
NO PARA USO HUMANO, DIAGNÓSTICO VETERINARIO O TERAPÉUTICO.
