Datos técnicos
| Fórmula | C22H24BrFN4O2 |
||||||
| Peso molecular | 475.35 | Número CAS | 443913-73-3 | ||||
| Solubilidad (25°C)* | In vitro | DMSO | 38 mg/mL (79.94 mM) | ||||
| Water | Insoluble | ||||||
| Ethanol | Insoluble | ||||||
| In vivo (Agregue los solventes al producto individualmente y en orden.) |
|
||||||
|
* <1 mg/ml significa ligeramente soluble o insoluble. * Tenga en cuenta que Selleck prueba la solubilidad de todos los compuestos internamente, y la solubilidad real puede diferir ligeramente de los valores publicados. Esto es normal y se debe a ligeras variaciones entre lotes. * Envío a temperatura ambiente (Las pruebas de estabilidad demuestran que este producto se puede enviar sin medidas de refrigeración.) |
|||||||
Preparación de soluciones madre
Actividad biológica
| Descripción | Vandetanib es un potente inhibidor de VEGFR2 con una IC50 de 40 nM en un ensayo sin células. También inhibe VEGFR3 y EGFR con IC50 de 110 nM y 500 nM, respectivamente. No es sensible a PDGFRβ, Flt1, Tie-2 y FGFR1 con IC50 de 1,1-3,6 μM. No tiene actividad contra MEK, CDK2, c-Kit, erbB2, FAK, PDK1, Akt e IGF-1R con IC50 superiores a 10 μM. Este compuesto aumenta la apoptosis e induce la autofagia al aumentar el nivel de especies reactivas de oxígeno (ROS). | ||||||
|---|---|---|---|---|---|---|---|
| Objetivos |
|
||||||
| In vitro | Vandetanib también inhibe VEGFR3 y EGFR con IC50 de 110 nM y 500 nM, respectivamente. Este compuesto no es sensible a PDGFRβ, Flt1, Tie-2 y FGFR1 con IC50 de 1,1-3,6 μM, mientras que casi no tiene actividad contra MEK, CDK2, c-Kit, erbB2, FAK, PDK1, Akt e IGF-1R con IC50 superiores a 10 μM. Inhibe la proliferación de HUVEC estimulada por VEGF, EGF y bFGF con IC50 de 60 nM, 170 nM y 800 nM, sin efecto sobre el crecimiento basal de células endoteliales. Este químico inhibe el crecimiento de células tumorales con IC50 de 2,7 μM (A549) a 13,5 μM (Calu-6). Muestra un efecto inhibidor sobre la ABCG2-ATPasa basal. Las células A431 parentales y las que expresan ABCG2 mostraron sensibilidades similares a este compuesto. La exposición a los inhibidores de EGFR disminuye los niveles de pEGFR en las células A431, y este compuesto muestra solo un efecto moderado. Muestra un efecto leve pero medible, mientras que el gefitinib, el pelitinib y el neratinib inhiben completamente el eflujo mediado por ABCG2 de mitoxantrona de las células A431/ABCG2, de manera similar al inhibidor específico de ABCG2 Ko143. Inhibe tanto las líneas celulares PC3wt como PC3R con IC50 similares de 13,3 μM y 11,5 μM, respectivamente. Este químico suprime la fosforilación de VEGFR2 en HUVEC y de EGFR en células de hepatoma e inhibe la proliferación celular. Causa una acumulación de células en las fases G0-G1 en células GEO y OVCAR-3 y aumenta la apoptosis en células OVCAR-3, ZR-75-1, MCF-10A ras y GEO. Este compuesto causa una inhibición dosis-dependiente de la fosforilación de EGFR en fibroblastos de ratón NIH-EGFR y células de cáncer de mama humanas MCF-10A ras, dos líneas celulares que sobreexpresan el EGFR humano. Su tratamiento resulta en una inhibición dosis-dependiente del crecimiento en agar blando en siete líneas celulares humanas (mama, colon, gástrico y ovárico) con EGFR funcional pero que carecen de VEGFR2. | ||||||
| In vivo | El Vandetanib (2,5 mg/kg, i.v.) revierte una hipotensión inducida por VEGF en un 63%, pero no afecta significativamente una hipotensión inducida por bFGF. Este compuesto (100 mg/kg) inhibe la formación de vasos sanguíneos inducida por el tumor en un 79%. Este (12,5-100 mg/kg, por vía oral) muestra una gran inhibición del crecimiento tumoral en xenoinjertos de tumores humanos, incluyendo Calu-6, PC-3, MDA-MA-231, SKOV-3, SW620, A549, A431, B16-F10(AP3) y Lewis Lung, con pocos efectos sobre el peso corporal. En xenoinjertos de PC3wt, la administración de este compuesto solo ejerce efectos estimulantes paradójicos del crecimiento tumoral. En xenoinjertos de PC3R, la dosis baja de este químico (25 mg/kg) no tiene un efecto significativo en relación con el control, mientras que la dosis alta (50 mg/kg) inhibe significativamente el crecimiento tumoral en comparación con el control. En contraste, la combinación de dosis altas revela una interacción negativa significativa entre este compuesto 50 mg/kg y docetaxel 30 mg/kg en células PC3R. En ratones portadores de tumores, suprime la fosforilación de VEGFR2 y EGFR en los tejidos tumorales, disminuye significativamente la densidad de vasos tumorales, mejora la apoptosis de las células tumorales, suprime el crecimiento tumoral, mejora la supervivencia, reduce el número de metástasis intrahepáticas y regula al alza VEGF, TGF-alfa y EGF en los tejidos tumorales. El tratamiento con este compuesto no se asocia con eventos adversos graves, incluida la anomalía de ALT, la supresión de la médula ósea o la pérdida de peso corporal. Este tratamiento químico de ratones desnudos que portan xenoinjertos de cáncer de colon GEO palpables (que son sensibles a la inhibición de la señalización EGFR) induce una inhibición del crecimiento tumoral dosis-dependiente. |
Protocolo (de referencia)
| Ensayo de quinasa: |
|
|---|---|
| Ensayo celular: |
|
| Estudio en animales: |
|
Referencias
|
Validación de productos por parte del cliente
![<p>Vandetanib reduced extracellular nitrite levels in endothelial cells. MS1 endothelial cells (ECs) were incubated with 1 mol/L of vandetanib or matched vehicle (dimethyl sulfoxide [DMSO]), 50 ng/mL of vascular endothelial growth factor (VEGF) or matched vehicle (PBS; 0.5 hours), and L-arginine and soluble N-ethylmaleamide sensitive factor attachment protein (SNAP) added (1.5 hours). Vandetanib lowered nitrite levels in MS1 Ecs (*P0.0003). VEGF was used a positive control and increased nitrite levels (**P0.02). These findings indicate that vandetanib lowered endothelial cell NO levels.</p>](https://file.selleckchem.com/downloads/review/700px/Vandetanib-Zactima-S104601Z0220100601.gif)
-
Datos de [ Hypertension , 2011 , 58, 85-92 ]
![<p>Vandetanib reduced phosphorylation of Akt in endothelial cells (ECs). MS1 ECs were incubated with 1 μmol/L of vandetanib or matched vehicle (dimethyl sulfoxide [DMSO]; 1 hour). Western blotting analysis showed that vandetanib decreased phosphorylation of Akt (S473) in MS1 ECs (*P<0.01; n=6 per group, studies done in triplicate). These findings show that vandetanib reduced Akt activity.</p>](https://file.selleckchem.com/downloads/review/700px/Vandetanib-Zactima-S104601W0320100601.gif)
-
Datos de [ Hypertension , 2011 , 58, 85-92 ]
![<p>Vandetanib increases membrane localization of endothelial NO synthase (eNOS). MS1 endothelial cells (ECs) were incubated with 1 μmol/L of vandetanib or matched vehicle (dimethyl sulfoxide [DMSO]). Western blotting analysis showed that vandetanib increases membrane localization of eNOS compared with control (*P<0.04; n=4 per group, studies done in triplicate). These findings show that vandetanib increased the membrane localization of eNOS compared with control.</p>](https://file.selleckchem.com/downloads/review/700px/Vandetanib-Zactima-S104601Z0420100601.gif)
-
Datos de [ Hypertension , 2011 , 58, 85-92 ]
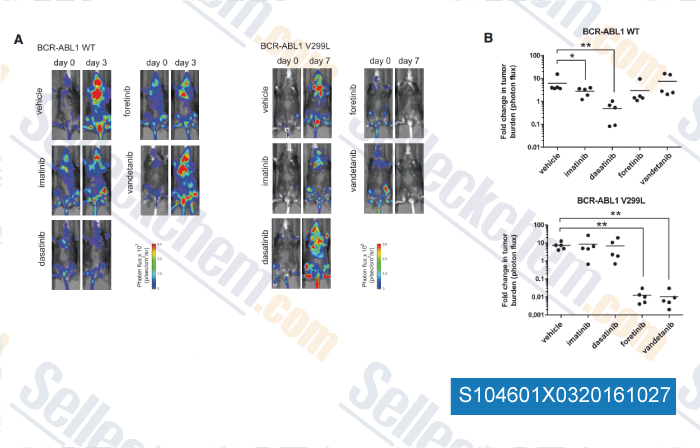
-
, , Cell, 2016, 165(1):234-46.
Sellecks Vandetanib Ha sido citado por 118 Publicaciones
| Ponatinib and other clinically approved inhibitors of Src and Rho-A kinases abrogate dengue virus serotype 2- induced endothelial permeability [ Virulence, 2025, 16(1):2489751] | PubMed: 40189910 |
| Kinase Plasticity in Response to Vandetanib Enhances Sensitivity to Tamoxifen in Estrogen Receptor Positive Breast Cancer [ bioRxiv, 2025, 2024.12.19.629395] | PubMed: 39975402 |
| CAVIN1-Mediated hERG Dynamics: A Novel Mechanism Underlying the Interindividual Variability in Drug-Induced Long QT [ Circulation, 2024, 150(7):563-576] | PubMed: 38682330 |
| Novel therapeutic strategies targeting bypass pathways and mitochondrial dysfunction to combat resistance to RET inhibitors in NSCLC [ Biochim Biophys Acta Mol Basis Dis, 2024, 1870(6):167249] | PubMed: 38768929 |
| Patient-derived rhabdomyosarcoma cells recapitulate the genetic and transcriptomic landscapes of primary tumors [ iScience, 2024, 27(10):110862] | PubMed: 39319271 |
| Vandetanib as a prospective anti-inflammatory and anti-contractile agent in asthma [ Front Pharmacol, 2024, 15:1345070] | PubMed: 38799165 |
| ETV2 primes hematoendothelial gene enhancers prior to hematoendothelial fate commitment [ Cell Rep, 2023, 42(6):112665] | PubMed: 37330911 |
| Nuclear translocation of cGAS orchestrates VEGF-A-mediated angiogenesis [ Cell Reports, 2023, 112328] | PubMed: None |
| Nuclear translocation of cGAS orchestrates VEGF-A-mediated angiogenesis [ Cell Rep, 2023, 42(4):112328] | PubMed: 37027305 |
| Phosphate-induced activation of VEGFR2 leads to caspase-9-mediated apoptosis of hypertrophic chondrocytes [ iScience, 2023, 26(9):107548] | PubMed: 37636062 |
POLÍTICA DE DEVOLUCIÓN
La Política de Devolución Incondicional de Selleck Chemical garantiza una experiencia de compra en línea fluida para nuestros clientes. Si no está satisfecho con su compra de alguna manera, puede devolver cualquier artículo(s) dentro de los 7 días posteriores a su recepción. En caso de problemas de calidad del producto, ya sean problemas relacionados con el protocolo o con el producto, puede devolver cualquier artículo(s) dentro de los 365 días a partir de la fecha de compra original. Siga las instrucciones a continuación al devolver productos.
ENVÍO Y ALMACENAMIENTO
Los productos Selleck se transportan a temperatura ambiente. Si recibe el producto a temperatura ambiente, tenga la seguridad de que el Departamento de Inspección de Calidad de Selleck ha realizado experimentos para verificar que la colocación a temperatura normal durante un mes no afectará la actividad biológica de los productos en polvo. Después de la recogida, guarde el producto de acuerdo con los requisitos descritos en la hoja de datos. La mayoría de los productos Selleck son estables en las condiciones recomendadas.
NO PARA USO HUMANO, DIAGNÓSTICO VETERINARIO O TERAPÉUTICO.
