Datos técnicos
| Fórmula | C23H28N8OS |
||||||
| Peso molecular | 464.59 | Número CAS | 639089-54-6 | ||||
| Solubilidad (25°C)* | In vitro | DMSO | 93 mg/mL (200.17 mM) | ||||
| Ethanol | 40 mg/mL (86.09 mM) | ||||||
| Water | Insoluble | ||||||
| In vivo (Agregue los solventes al producto individualmente y en orden.) |
|
||||||
|
* <1 mg/ml significa ligeramente soluble o insoluble. * Tenga en cuenta que Selleck prueba la solubilidad de todos los compuestos internamente, y la solubilidad real puede diferir ligeramente de los valores publicados. Esto es normal y se debe a ligeras variaciones entre lotes. * Envío a temperatura ambiente (Las pruebas de estabilidad demuestran que este producto se puede enviar sin medidas de refrigeración.) |
|||||||
Preparación de soluciones madre
Actividad biológica
| Descripción | Tozasertib (VX-680) es un inhibidor pan-Aurora, principalmente contra Aurora A con un Kiapp de 0,6 nM en un ensayo sin células, menos potente contra Aurora B/Aurora C y 100 veces más selectivo para Aurora A que otras 55 quinasas. Las únicas excepciones son la tirosina quinasa-3 relacionada con Fms (FLT-3) y la tirosina quinasa BCR-ABL, que son inhibidas por este compuesto con un Ki de 30 nM para ambas. Induce apoptosis y autophagy, y se encuentra en Fase 2. | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Objetivos |
|
||||||||||
| In vitro | Aunque su perfil multi-quinasa, Tozasertib (VX-680) induce una citotoxicidad similar con una IC50 de aproximadamente 300 nM y exhibe un fenotipo inhibidor tipo AUR B de arresto G2/M, endorreduplicación y apoptosis en células BaF3 transfectadas con quinasas ABL o FLT-3 (mutante y tipo salvaje). Este compuesto previene la proliferación de CAL-62 de manera tiempo-dependiente. El tratamiento durante 14 días disminuye significativamente el número y tamaño de las colonias en aproximadamente un 70% en 8305C y un 90% en CAL-62, 8505C y BHT-101. El tratamiento de las diferentes células ATC con él inhibe la proliferación con una IC50 entre 25 y 150 nM. Afecta significativamente la capacidad de las diferentes líneas celulares para formar colonias en agar blando. El análisis de la actividad de la caspasa-3 indica que VX-680 induce apoptosis en las diferentes líneas celulares. Las células CAL-62 expuestas durante 12 horas al compuesto mostraron una acumulación de células con un contenido de ADN ≥4N. El análisis de lapso de tiempo demuestra que las células CAL-62 tratadas salen de la metafase sin dividirse. Además, la fosforilación de la histona H3 se anula después de su tratamiento. Tiene una actividad inhibidora significativa contra BCR-Abl que porta la mutación T315I en muestras derivadas de pacientes. | ||||||||||
| In vivo | Tozasertib (VX-680) provoca una marcada disminución del tamaño del tumor en un modelo de xenoinjerto de LMA humana (HL-60). En ratones desnudos tratados con él a 75 mg/kg, dos veces al día por vía intraperitoneal (b.i.d. i.p.) durante 13 días, los volúmenes tumorales medios se reducen en un 98%. La disminución del crecimiento tumoral es dosis-dependiente y significativa a una dosis de 12.5 mg/kg b.i.d. Este compuesto es bien tolerado, con una pequeña disminución del peso corporal observada solo a la dosis más alta. También desencadena la regresión tumoral en modelos de xenoinjertos pancreáticos y de colon. Tozasertib también muestra una potente actividad antitumoral cuando se infunde i.v. en ratas desnudas que portan tumores HCT116 establecidos. Una dosis más alta (2 mg/kg/h) mejora la eficacia con una disminución del 56% en el volumen tumoral medio. |
Protocolo (de referencia)
| Ensayo de quinasa: |
|
|---|---|
| Ensayo celular: |
|
| Estudio en animales: |
|
Referencias
|
Validación de productos por parte del cliente
-
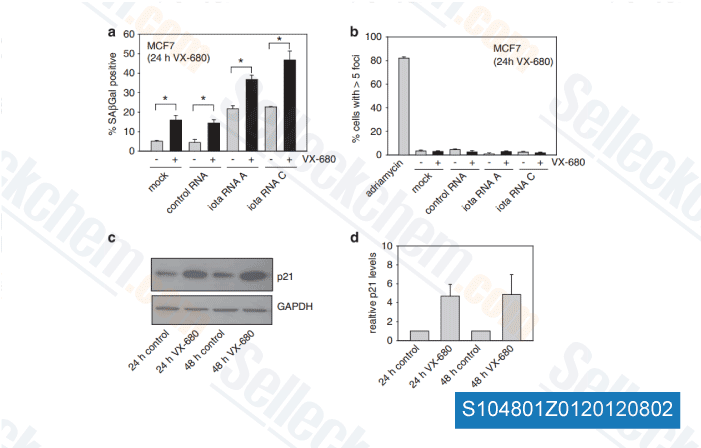
Datos de [ Oncogene , 2012 , 31, 3584-96 ]

-
Datos de [ Oncogene , 2012 , 31, 3584-96 ]
-
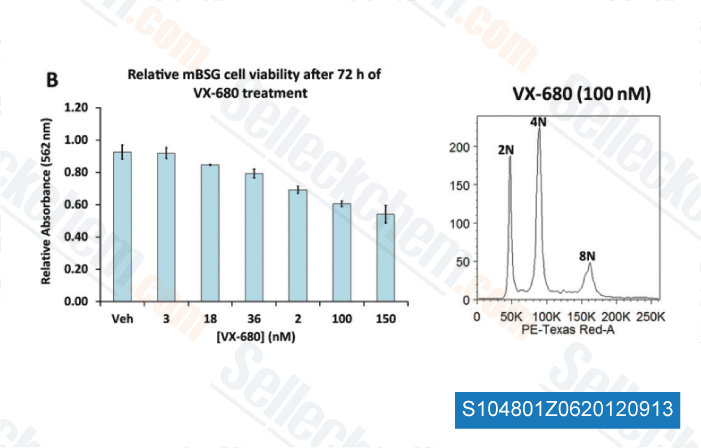
Datos de [ Brain Pathol , 2012 , 23, 244-53 ]
-
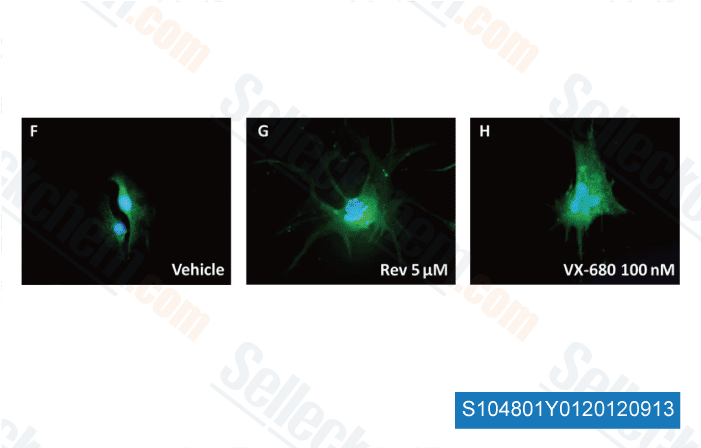
Datos de [ Brain Pathol , 2012 , 23, 244-53 ]
Sellecks Tozasertib (VX-680) Ha sido citado por 139 Publicaciones
| A patient-derived T cell lymphoma biorepository uncovers pathogenetic mechanisms and host-related therapeutic vulnerabilities [ Cell Rep Med, 2025, S2666-3791(25)00102-8] | PubMed: 40147445 |
| Overcoming MET-targeted drug resistance in MET-amplified lung cancer by aurora kinase B inhibition [ Biochim Biophys Acta Mol Cell Res, 2025, 1872(7):120001] | PubMed: 40499687 |
| Hedgehog signalling is involved in acquired resistance to KRASG12C inhibitors in lung cancer cells [ Cell Death Dis, 2024, 15(1):56] | PubMed: 38225225 |
| Dynamic phosphorylation of FOXA1 by Aurora B guides post-mitotic gene reactivation [ Cell Rep, 2024, 43(9):114739] | PubMed: 39276350 |
| The molecular basis of Abelson kinase regulation by its αI-helix [ Elife, 2024, 12RP92324] | PubMed: 38588001 |
| Tozasertib activates anti-tumor immunity through decreasing regulatory T cells in melanoma [ Neoplasia, 2024, 48:100966] | PubMed: 38237304 |
| Machine learning based androgen receptor regulatory gene-related random forest survival model for precise treatment decision in prostate cancer [ Heliyon, 2024, 10(17):e37256] | PubMed: 39296076 |
| Visualization strategies to aid interpretation of high-dimensional genotoxicity data [ Environ Mol Mutagen, 2024, 10.1002/em.22604] | PubMed: 38757760 |
| Molecular landscape and functional characterization of centrosome amplification in ovarian cancer [ Nat Commun, 2023, 14(1):6505] | PubMed: 37845213 |
| Mitotic Dysregulation at Tumor Initiation Creates a Therapeutic Vulnerability to Combination Anti-Mitotic and Pro-Apoptotic Agents for MYCN-Driven Neuroblastoma [ Int J Mol Sci, 2023, 10.3390/ijms242115571] | PubMed: 37958555 |
POLÍTICA DE DEVOLUCIÓN
La Política de Devolución Incondicional de Selleck Chemical garantiza una experiencia de compra en línea fluida para nuestros clientes. Si no está satisfecho con su compra de alguna manera, puede devolver cualquier artículo(s) dentro de los 7 días posteriores a su recepción. En caso de problemas de calidad del producto, ya sean problemas relacionados con el protocolo o con el producto, puede devolver cualquier artículo(s) dentro de los 365 días a partir de la fecha de compra original. Siga las instrucciones a continuación al devolver productos.
ENVÍO Y ALMACENAMIENTO
Los productos Selleck se transportan a temperatura ambiente. Si recibe el producto a temperatura ambiente, tenga la seguridad de que el Departamento de Inspección de Calidad de Selleck ha realizado experimentos para verificar que la colocación a temperatura normal durante un mes no afectará la actividad biológica de los productos en polvo. Después de la recogida, guarde el producto de acuerdo con los requisitos descritos en la hoja de datos. La mayoría de los productos Selleck son estables en las condiciones recomendadas.
NO PARA USO HUMANO, DIAGNÓSTICO VETERINARIO O TERAPÉUTICO.
