Datos técnicos
| Fórmula | C18H18N2O3 |
||||||
| Peso molecular | 310.35 | Número CAS | 252916-29-3 | ||||
| Solubilidad (25°C)* | In vitro | DMSO | 62 mg/mL (199.77 mM) | ||||
| Water | Insoluble | ||||||
| Ethanol | Insoluble | ||||||
| In vivo (Agregue los solventes al producto individualmente y en orden.) |
|
||||||
|
* <1 mg/ml significa ligeramente soluble o insoluble. * Tenga en cuenta que Selleck prueba la solubilidad de todos los compuestos internamente, y la solubilidad real puede diferir ligeramente de los valores publicados. Esto es normal y se debe a ligeras variaciones entre lotes. * Envío a temperatura ambiente (Las pruebas de estabilidad demuestran que este producto se puede enviar sin medidas de refrigeración.) |
|||||||
Preparación de soluciones madre
Actividad biológica
| Descripción | Orantinib (SU6668) tiene la mayor potencia contra la autofosforilación de PDGFR con un Ki de 8 nM en un ensayo sin células, pero también inhibe fuertemente la transfosforilación de Flk-1 y FGFR1. Muestra poca actividad contra IGF-1R, Met, Src, Lck, Zap70, Abl y CDK2, y no inhibe el EGFR. Este compuesto está en Fase 3. | ||
|---|---|---|---|
| Objetivos |
|
||
| In vitro | Orantinib (SU6668) es un inhibidor competitivo, con respecto al ATP, de la transfosforilación de Flk-1/KDR, la transfosforilación de FGFR1 y la autofosforilación de las quinasas PDGFRβ. Inhibe (0,03-10 μM) la fosforilación de tirosina de KDR en HUVEC estimuladas por VEGF. Este compuesto también inhibe la fosforilación de tirosina de PDGFRβ estimulada por PDGF en células NIH-3T3 que sobreexpresan PDGFRβ a una concentración mínima de 0,03-0,1 μM. Inhibe la fosforilación inducida por FGF ácido del sustrato 2 de FGFR1 a 10 μM y superiores. Sin embargo, TSU-68 (hasta 100 μM) no tiene efecto sobre la fosforilación de tirosina de EGFR estimulada por EGF en células NIH-3T3 que sobreexpresan EGFR. Inhibe la mitogénesis de HUVEC impulsada por VEGF y FGF con una IC50 media de 0,34 μM y 9,6 μM, respectivamente. En células MO7E de leucemia mieloide humana, este compuesto inhibe la autofosforilación de tirosina del receptor del factor de células madre (SCF), c-kit, con una IC50 de 0,1-1 μM, así como la fosforilación de ERK1/2, un evento de señalización aguas abajo de la activación de c-kit. También inhibe la proliferación de células MO7E inducida por SCF con una IC50 de 0,29 μM, e induce apoptosis. | ||
| In vivo | Orantinib (SU6668) induce la inhibición del crecimiento tumoral contra una amplia gama de tipos de tumores en modelos de xenoinjerto en ratones atímicos, incluyendo células A375, Colo205, H460, Calu-6, C6, SF763T y SKOV3TP5 a dosis de 75-200 mg/kg. Este compuesto (75 mg/kg) también suprime la angiogénesis tumoral de los xenoinjertos de glioma C6. En un modelo tumoral de carcinoma de colon humano HT29, (200 mg/kg) disminuye la permeabilidad vascular media y el volumen plasmático fraccional medio en el borde y el núcleo del tumor. TSU-68 promueve el desarrollo estromal anormal en la periferia de los carcinomas. En un modelo de tumor hepático VX2 en conejo, (200 mg/kg) aumenta el efecto de la infusión quimioterapéutica. |
Protocolo (de referencia)
| Ensayo de quinasa: |
|
|---|---|
| Ensayo celular: |
|
| Estudio en animales: |
|
Referencias
|
Validación de productos por parte del cliente
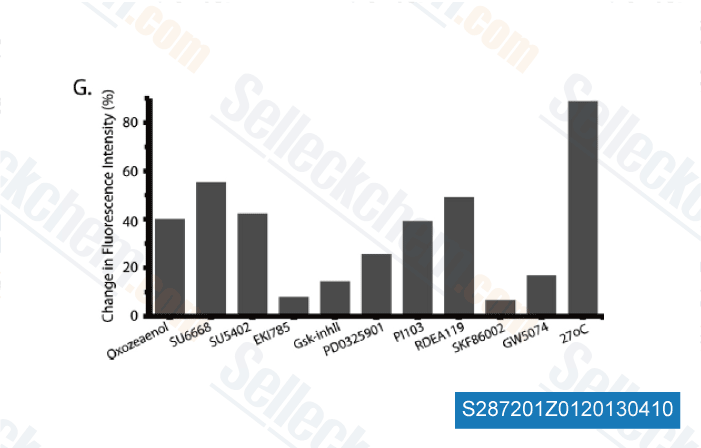
-
Datos de [ Mol Cell Proteomics , 2012 ]

-
Datos de [ Mol Cell Proteomics , 2012 ]
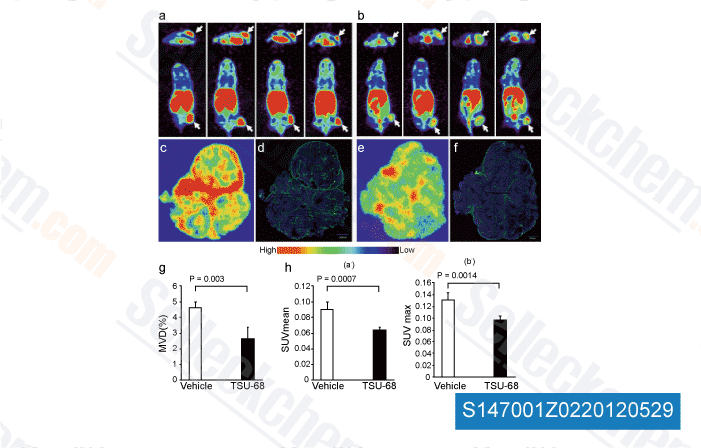
-
Datos de [ Angiogenesis , 2012 , 15, 569-80 ]
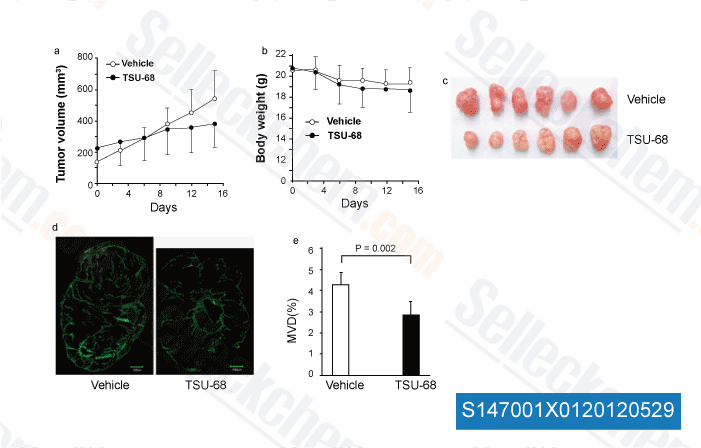
-
Datos de [ Angiogenesis , 2012 , 15, 569-80 ]
Sellecks Orantinib (SU6668) Ha sido citado por 21 Publicaciones
| SMYD5 is a novel epigenetic gatekeeper of the mild hypothermia response [ bioRxiv, 2023, 2023.05.11.540170] | PubMed: 37333301 |
| Establishment and Characterization of NCC-PMP1-C1: A Novel Patient-Derived Cell Line of Metastatic Pseudomyxoma Peritonei [ J Pers Med, 2022, 12(2)258] | PubMed: 35207746 |
| Establishment and characterization of NCC-UPS4-C1: a novel cell line of undifferentiated pleomorphic sarcoma from a patient with Li-Fraumeni syndrome [ Hum Cell, 2022, 10.1007/s13577-022-00671-y] | PubMed: 35118583 |
| Establishment and characterization of NCC-MFS4-C1: a novel patient-derived cell line of myxofibrosarcoma [ Hum Cell, 2021, 34(6):1911-1918] | PubMed: 34383271 |
| Establishment and characterization of the NCC-GCTB4-C1 cell line: a novel patient-derived cell line from giant cell tumor of bone [ Hum Cell, 2021, 10.1007/s13577-021-00639-4] | PubMed: 34731453 |
| Establishment and characterization of novel patient-derived cell lines from giant cell tumor of bone [ Hum Cell, 2021, 10.1007/s13577-021-00579-z] | PubMed: 34304386 |
| The Meningioma Enhancer Landscape Delineates Novel Subgroups and Drives Druggable Dependencies [ Cancer Discov, 2020, CD-20-0160] | PubMed: 32703768 |
| Establishment and characterization of NCC-MFS2-C1: a novel patient-derived cancer cell line of myxofibrosarcoma [ Hum Cell, 2020, 10.1007/s13577-020-00420-z] | PubMed: 32870449 |
| Multi-omic Profiling Reveals Dynamics of the Phased Progression of Pluripotency. [ Cell Syst, 2019, 8(5):427-445] | PubMed: 31078527 |
| Intratumoural Heterogeneity Underlies Distinct Therapy Responses and Treatment Resistance in Glioblastoma. [ Cancers (Basel), 2019, 11(2)] | PubMed: 30736342 |
POLÍTICA DE DEVOLUCIÓN
La Política de Devolución Incondicional de Selleck Chemical garantiza una experiencia de compra en línea fluida para nuestros clientes. Si no está satisfecho con su compra de alguna manera, puede devolver cualquier artículo(s) dentro de los 7 días posteriores a su recepción. En caso de problemas de calidad del producto, ya sean problemas relacionados con el protocolo o con el producto, puede devolver cualquier artículo(s) dentro de los 365 días a partir de la fecha de compra original. Siga las instrucciones a continuación al devolver productos.
ENVÍO Y ALMACENAMIENTO
Los productos Selleck se transportan a temperatura ambiente. Si recibe el producto a temperatura ambiente, tenga la seguridad de que el Departamento de Inspección de Calidad de Selleck ha realizado experimentos para verificar que la colocación a temperatura normal durante un mes no afectará la actividad biológica de los productos en polvo. Después de la recogida, guarde el producto de acuerdo con los requisitos descritos en la hoja de datos. La mayoría de los productos Selleck son estables en las condiciones recomendadas.
NO PARA USO HUMANO, DIAGNÓSTICO VETERINARIO O TERAPÉUTICO.
