Datos técnicos
| Fórmula | C21H22Cl2FN5O |
||||||||||||||
| Peso molecular | 450.34 | Número CAS | 877399-52-5 | ||||||||||||
| Solubilidad (25°C)* | In vitro | DMSO | 25 mg/mL (55.51 mM) | ||||||||||||
| Water | Insoluble | ||||||||||||||
| Ethanol | Insoluble | ||||||||||||||
| In vivo (Agregue los solventes al producto individualmente y en orden.) |
|
||||||||||||||
|
* <1 mg/ml significa ligeramente soluble o insoluble. * Tenga en cuenta que Selleck prueba la solubilidad de todos los compuestos internamente, y la solubilidad real puede diferir ligeramente de los valores publicados. Esto es normal y se debe a ligeras variaciones entre lotes. * Envío a temperatura ambiente (Las pruebas de estabilidad demuestran que este producto se puede enviar sin medidas de refrigeración.) |
|||||||||||||||
Preparación de soluciones madre
Actividad biológica
| Descripción | Crizotinib es un potente inhibidor de c-Met y ALK con IC50 de 11 nM y 24 nM en ensayos basados en células, respectivamente. También es un potente inhibidor de ROS1 con un valor Ki inferior a 0,025 nM. Crizotinib induce la autofagia a través de la inhibición de la vía STAT3 en múltiples líneas celulares de cáncer de pulmón. | ||||||
|---|---|---|---|---|---|---|---|
| Objetivos |
|
||||||
| In vitro | PF-2341066 muestra una potencia similar contra la fosforilación de c-Met en células epiteliales de ratón mIMCD3 o de perro MDCK con IC50 de 5 nM y 20 nM, respectivamente. Este compuesto muestra una actividad mejorada o similar contra células NIH3T3 diseñadas para expresar los mutantes del sitio de unión a ATP de c-Met V1092I o H1094R o el mutante del bucle P M1250T con IC50 de 19 nM, 2 nM y 15 nM, respectivamente, en comparación con células NIH3T3 que expresan el receptor de tipo salvaje con IC50 de 13 nM. En contraste, se observa un marcado cambio en la potencia de este compuesto contra células diseñadas para expresar los mutantes del bucle de activación de c-Met Y1230C e Y1235D con IC50 de 127 nM y 92 nM, respectivamente, en comparación con el receptor de tipo salvaje. También previene potentemente la fosforilación de c-Met en células NCI-H69 y HOP92, con IC50 de 13 nM y 16 nM, respectivamente, que expresan las variantes endógenas de c-Met R988C y T1010I, respectivamente. Este compuesto es >1.000 veces selectivo para los RTK VEGFR2 y PDGFRβ, >250 veces selectivo para IRK y Lck, y ~40 a 60 veces selectivo para Tie2, TrkA y TrkB, todo en comparación con c-Met. Es 20 a 30 veces selectivo para los RTK RON y Axl. En contraste, este compuesto muestra una IC50 casi equivalente de 24 nM contra la variante de fusión oncogénica nucleofosmina (NPM)-cinasa de linfoma anaplásico (ALK) del RTK ALK expresado por la línea celular de linfoma anaplásico de células grandes humano (ALCL) KARPAS299. Inhibe los fenotipos neoplásicos dependientes de c-Met de las células cancerosas y los fenotipos angiogénicos de las células endoteliales. Este químico suprime el crecimiento de células de carcinoma gástrico humano GTL-16 con una IC50 de 9,7 nM. Induce la apoptosis en células GTL-16 con una IC50 de 8,4 nM. Inhibe la migración e invasión de células de carcinoma pulmonar humano NCI-H441 estimuladas por HGF con IC50 de 11 nM y 6,1 nM, respectivamente. Inhibe la dispersión de células MDCK con una IC50 de 16 nM. Previene la fosforilación de c-Met, la supervivencia celular y la invasión de Matrigel estimuladas por HGF con IC50 de 11 nM, 14 nM y 35 nM, respectivamente. Además, previene la tubulogénesis de ramificación de HMVEC estimulada por suero (formación de tubos vasculares) en geles de fibrina. También inhibe potentemente la fosforilación de NPM-ALK en células ALCL Karpas299 o SU-DHL-1 con una IC50 de 24 nM. Este compuesto previene potentemente la proliferación celular, que se asocia con la detención del ciclo celular en fase G(1)-S y la inducción de apoptosis en células ALCL ALK-positivas con IC50 de 30 nM, pero no en células de linfoma ALK-negativas. Además, previene el comportamiento de osteosarcoma asociado con el crecimiento tumoral primario (es decir, proliferación y supervivencia), así como con la metástasis (p. ej., invasión y clonogenicidad). |
||||||
| In vivo | En el modelo GTL-16, PF-2341066 revela la capacidad de causar una marcada regresión de grandes tumores establecidos (>600 mm3) tanto en las cohortes de tratamiento de 50 mg/kg/día como de 75 mg/kg/día, con una disminución del 60% en el volumen tumoral medio durante el programa de administración de 43 días. En otro estudio, este compuesto muestra la capacidad de inhibir completamente el crecimiento tumoral de GTL-16 durante >3 meses, con solo 1 de cada 12 ratones que exhibe un aumento significativo en el crecimiento tumoral durante el programa de tratamiento de 3 meses a 50 mg/kg/día. En el modelo de NSCLC NCI-H441, se observa una disminución del 43% en el volumen tumoral medio a 50 mg/kg/día durante el ciclo de administración de PF-2341066 de 38 días. En el modelo de CCR Caki-1, se observa una disminución del 53% en el volumen tumoral medio asociada con una disminución del volumen de cada tumor en al menos un 30% a 50 mg/kg/día durante el ciclo de administración de PF-2341066 de 33 días. Este compuesto también revela una prevención casi completa del crecimiento de tumores establecidos a 50 mg/kg/día en los modelos de xenoinjertos de glioblastoma U87MG o carcinoma de próstata PC-3, con una inhibición del 97% u 84% en el último día del estudio, respectivamente. En contraste, este químico administrado por vía oral a 50 mg/kg/día no inhibe significativamente el crecimiento tumoral en el modelo de carcinoma de mama MDA-MB-231, o el modelo de carcinoma de colon DLD-1. Se observa una reducción significativa dependiente de la dosis de células endoteliales positivas a CD31 a 12,5 mg/kg/día, 25 mg/kg/día y 50 mg/kg/día en tumores GTL-16, lo que indica que la inhibición de la MVD muestra una correlación dependiente de la dosis con la eficacia antitumoral. Este compuesto muestra una reducción significativa dependiente de la dosis de los niveles plasmáticos humanos de VEGFA e IL-8 en los modelos GTL-16 y U87MG. Se observa una marcada inhibición de los niveles fosforilados de c-Met, Akt, Erk, PLCλ1 y STAT5 en tumores GTL-16 después de la administración oral de este compuesto. La administración oral de este químico a ratones SCID-Beige con xenoinjertos tumorales de ALCL Karpas299 conduce a una eficacia antitumoral dependiente de la dosis con regresión completa de todos los tumores a la dosis de 100 mg/kg/día dentro de los 15 días posteriores a la administración inicial del compuesto. Además, la inhibición de mediadores clave de la señalización NPM-ALK, incluida la fosfolipasa C-gamma, los transductores de señal y activadores de la transcripción 3, las quinasas reguladas por señales extracelulares y Akt por este compuesto se observa en concentraciones o niveles de dosis, que se correlacionaron con la inhibición de la fosforilación y función de NPM-ALK. Este compuesto previene el comportamiento de osteosarcoma asociado con el crecimiento tumoral primario (p. ej., proliferación y supervivencia) así como con la metástasis (p. ej., invasión y clonogenicidad). En ratones desnudos tratados con este químico mediante sonda oral, el crecimiento y la osteólisis asociada y la formación de matriz ósea extracortical de los xenoinjertos de osteosarcoma son prevenidos por este compuesto. El tratamiento de xenoinjertos GTL-16 amplificados en c-MET con 50 mg/kg de este compuesto provoca una regresión tumoral que se asocia con una lenta reducción en la captación de 18F-FDG y disminuye la expresión del transportador de glucosa 1, GLUT-1. |
Protocolo (de referencia)
| Ensayo de quinasa: |
|
|---|---|
| Ensayo celular: |
|
| Estudio en animales: |
|
Referencias
|
Validación de productos por parte del cliente
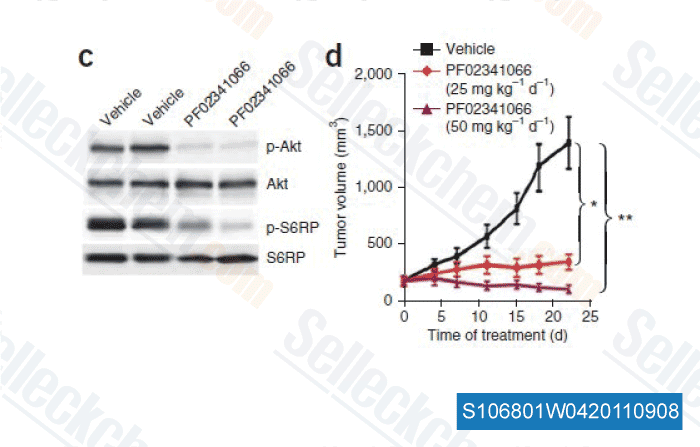
-
Datos de [ Nat Med , 2011 , 17, 1116-1120 ]
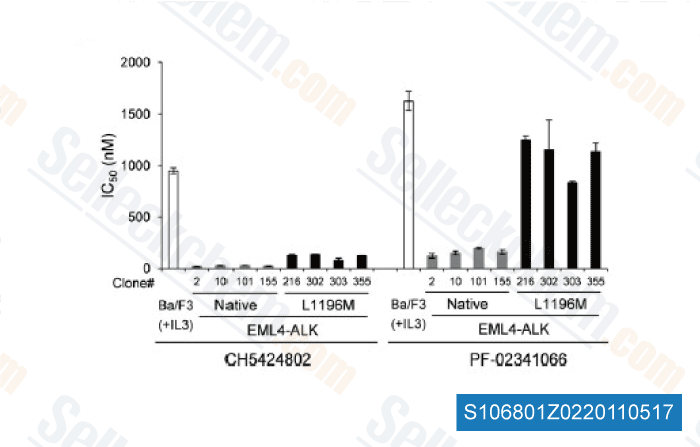
-
Datos de [ Cancer Cell , 2011 , 19, 679–690 ]
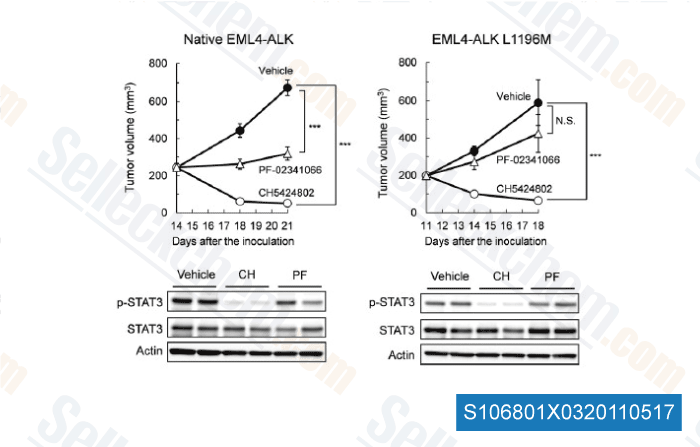
-
Datos de [ Cancer Cell , 2011 , 19, 679–690 ]

-
Datos de [ J Biomol Screen , 2011 , 16, 141-154 ]
Sellecks PF-02341066 (Crizotinib) Ha sido citado por 499 Publicaciones
| RNase1-driven ALK-activation is an oncogenic driver and therapeutic target in non-small cell lung cancer [ Signal Transduct Target Ther, 2025, 10(1):124] | PubMed: 40246819 |
| A patient-derived T cell lymphoma biorepository uncovers pathogenetic mechanisms and host-related therapeutic vulnerabilities [ Cell Rep Med, 2025, S2666-3791(25)00102-8] | PubMed: 40147445 |
| ARID1A loss enhances sensitivity to c-MET inhibition by dual targeting of GPX4 and iron homeostasis, inducing ferroptosis [ Cell Death Differ, 2025, 10.1038/s41418-025-01510-x] | PubMed: 40369167 |
| Targeting proteostasis in multiple myeloma through inhibition of LTK [ Leukemia, 2025, 10.1038/s41375-025-02682-8] | PubMed: 40634511 |
| Multi-layer stratified oncology platform utilizing transcriptomics, prostate cancer organoids, and modeling of drug response [ J Exp Clin Cancer Res, 2025, 44(1):290] | PubMed: 41094672 |
| Novel selective strategies targeting the BCL-2 family to enhance clinical efficacy in ALK-rearranged non-small cell lung cancer [ Cell Death Dis, 2025, 16(1):194] | PubMed: 40113795 |
| The Src family kinase inhibitor drug Dasatinib and glucocorticoids display synergistic activity against tongue squamous cell carcinoma and reduce MET kinase activity [ Cell Commun Signal, 2025, 23(1):293] | PubMed: 40537792 |
| MET variants with activating N-lobe mutations identified in hereditary papillary renal cell carcinomas still require ligand stimulation [ Mol Oncol, 2025, 19(8):2366-2387] | PubMed: 39980226 |
| Synergistic effects of oncogene inhibition and pyruvate dehydrogenase kinase blockade in resistant NSCLC cells [ Biochim Biophys Acta Mol Basis Dis, 2025, 1871(8):168014] | PubMed: 40784600 |
| HGF Overexpression in Mesenchymal Stromal Cell-Based Cell Sheets Enhances Autophagy-Dependent Cytoprotection and Proliferation to Guard the Epicardial Mesothelium [ Int J Mol Sci, 2025, 26(15)7298] | PubMed: 40806435 |
POLÍTICA DE DEVOLUCIÓN
La Política de Devolución Incondicional de Selleck Chemical garantiza una experiencia de compra en línea fluida para nuestros clientes. Si no está satisfecho con su compra de alguna manera, puede devolver cualquier artículo(s) dentro de los 7 días posteriores a su recepción. En caso de problemas de calidad del producto, ya sean problemas relacionados con el protocolo o con el producto, puede devolver cualquier artículo(s) dentro de los 365 días a partir de la fecha de compra original. Siga las instrucciones a continuación al devolver productos.
ENVÍO Y ALMACENAMIENTO
Los productos Selleck se transportan a temperatura ambiente. Si recibe el producto a temperatura ambiente, tenga la seguridad de que el Departamento de Inspección de Calidad de Selleck ha realizado experimentos para verificar que la colocación a temperatura normal durante un mes no afectará la actividad biológica de los productos en polvo. Después de la recogida, guarde el producto de acuerdo con los requisitos descritos en la hoja de datos. La mayoría de los productos Selleck son estables en las condiciones recomendadas.
NO PARA USO HUMANO, DIAGNÓSTICO VETERINARIO O TERAPÉUTICO.
